
Wetenschap
Waarom kan fluor niet worden bereid door oxidatie van fluoride -ionen?
Dit is waarom:
* Hoge elektronegativiteit: Fluor's sterke aantrekkingskracht voor elektronen maakt het uiterst moeilijk om elektronen uit fluoride -ionen (F⁻) te verwijderen.
* Strong oxidatiemiddel: Fluor is zo'n krachtig oxidatiemiddel dat het gemakkelijk elektronen van andere elementen accepteert. Dit betekent dat het gemakkelijk andere stoffen zal oxideren, maar het kan zelf niet worden geoxideerd.
* Geen sterkere oxidatiemiddel: Er is geen bekend oxidatiemiddel sterker dan fluor die het kan dwingen elektronen te verliezen.
Hoewel andere halogenen zoals chloor kunnen worden bereid door hun respectieve halogenide -ionen te oxideren, vereist fluor een andere bereidingsmethode, zoals elektrolyse van een fluoridezout zoals kaliumfluoride in een gesmolten toestand.
 Studie onthult ongewoon hoge koolstofvoorraden en boomdiversiteit in het Darien-woud in Panama
Studie onthult ongewoon hoge koolstofvoorraden en boomdiversiteit in het Darien-woud in Panama Hoe verklaart het idee van atomen het behoud van de priciënetel?
Hoe verklaart het idee van atomen het behoud van de priciënetel?  Toekomstige orkanen kunnen het vermogen van de bossen in New England om koolstof op te slaan en vast te leggen in gevaar brengen
Toekomstige orkanen kunnen het vermogen van de bossen in New England om koolstof op te slaan en vast te leggen in gevaar brengen  Wat zijn de twee krachten die de aarde op dit pad houden?
Wat zijn de twee krachten die de aarde op dit pad houden?  Het is nog niet te laat om watervoorraden in snel verstedelijkende gebieden te behouden
Het is nog niet te laat om watervoorraden in snel verstedelijkende gebieden te behouden
Hoofdlijnen
- Kan het beschermen van onze eiwitten ons helpen veroudering te voorkomen?
- Wetenschap van functies menselijk lichaam?
- Wat is Abiotic in het ecosysteem?
- Antibioticaresistente infecties bij huisdieren
- Zijn eicellen van ouder wordende primaten beschermd tegen mutaties?
- Waar worden mesenchymale stamcellen voor gebruikt?
- Wat is een eencellige eukaryoot?
- Wat is de koolhydraten in plantencelwanden?
- Wetenschappers onthullen waarom bosbessen blauw zijn
- Vormverschuivende organische kristallen gebruiken geheugen om plastic elektronica te verbeteren

- Zachte robotactuatoren genezen zichzelf
- Wetenschappers creëren aanpasbare, stofachtige stroombron voor draagbare elektronica

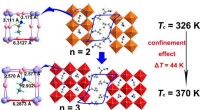
- Onderzoekers verwerven gelaagde metaalhalogenide-ferro-elektriciteit met hoge Curie-temperatuur via kooi-begrensde ethylaminerotators
- Chemici maken hernieuwbare plantaardige polymeren

 Onderzoek naar interacties op moleculaire kruispunten voor nieuwe elektronische apparaten
Onderzoek naar interacties op moleculaire kruispunten voor nieuwe elektronische apparaten  Nieuwe 'verticale kaart' van micro-organismen in de lucht geeft aan hoe de opwarming van de aarde ecosystemen zal beïnvloeden
Nieuwe 'verticale kaart' van micro-organismen in de lucht geeft aan hoe de opwarming van de aarde ecosystemen zal beïnvloeden  Welke buitenplaneten hebben periodes van rotatie korter dan de aarde?
Welke buitenplaneten hebben periodes van rotatie korter dan de aarde?  Waar is tape van gemaakt?
Waar is tape van gemaakt?  Wat vinden het jodendom van het transplanteerde orgaan?
Wat vinden het jodendom van het transplanteerde orgaan?  Wat zijn de belangrijkste landvormen van Polen?
Wat zijn de belangrijkste landvormen van Polen?  Atmosferische wetenschappers bieden aanwijzingen voor klimaatverandering in nieuwe studies
Atmosferische wetenschappers bieden aanwijzingen voor klimaatverandering in nieuwe studies Hoe een computer leert dribbelen:oefenen, oefening, oefening
Hoe een computer leert dribbelen:oefenen, oefening, oefening
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

