
Wetenschap
Wat is de Notatie van de elektronenconfiguratie voor Germanium?
1S² 2S² 2P⁶ 3S² 3P⁶ 4S² 3D¹⁰ 4P²
Hier is hoe het kapot gaat:
* 1S²: Het eerste energieniveau (n =1) heeft 2 elektronen in het orbitaal.
* 2S²: Het tweede energieniveau (n =2) heeft 2 elektronen in het s orbitaal.
* 2p⁶: Het tweede energieniveau (n =2) heeft 6 elektronen in het P -orbitaal.
* 3S²: Het derde energieniveau (n =3) heeft 2 elektronen in het orbitaal.
* 3P⁶: Het derde energieniveau (n =3) heeft 6 elektronen in het P -orbitaal.
* 4S²: Het vierde energieniveau (n =4) heeft 2 elektronen in het s orbitaal.
* 3d¹⁰: Het derde energieniveau (n =3) heeft 10 elektronen in de D orbital.
* 4p²: Het vierde energieniveau (n =4) heeft 2 elektronen in het P -orbitaal.
Deze configuratie weerspiegelt de volgorde waarin elektronen orbitalen vullen, volgens het AUFBAU -principe en de regel van HUWD.
 Satellietbeeld legt ontwikkeling van tropische stormdepressie 8E vast
Satellietbeeld legt ontwikkeling van tropische stormdepressie 8E vast De meren verdrievoudigen de hoeveelheid koolstof die ze begraven als reactie op de menselijke verstoring van de wereldwijde nutriëntenkringlopen
De meren verdrievoudigen de hoeveelheid koolstof die ze begraven als reactie op de menselijke verstoring van de wereldwijde nutriëntenkringlopen Pure wetenschap is de voortdurende zoektocht naar wetenschappelijk?
Pure wetenschap is de voortdurende zoektocht naar wetenschappelijk?  Kaken ontmoet kangoeroe? Zeldzame, schattige zakhaai diep gevonden
Kaken ontmoet kangoeroe? Zeldzame, schattige zakhaai diep gevonden  Grotere overstromingsrisico's in de kuststreek van China door tragere tropische cycloonbeweging
Grotere overstromingsrisico's in de kuststreek van China door tragere tropische cycloonbeweging
Hoofdlijnen
- Welk kenmerk in woord bestaat uit cellen?
- Modellen tonen aan dat koralen beter bestand zijn tegen de opwarming van de oceaan als ze ruilen voor hittebestendige algenvariëteiten
- Onderzoeker ontdekt dat houtkikkers snel evolueerden als reactie op strooizout
- Hoe worden bacterieclusters genoemd?
- Welk lichaamssysteem houdt menselijke soorten op deze planeet?
- Wat is hoogstwaarschijnlijk de verklaring voor hoe speciatie optreedt?
- Wat zijn gespecialiseerde cellen en wat voor soort organisme ze hebben gevonden?
- Vleermuizen zijn gastheer voor een reeks virussen, maar worden niet ziek. Waarom?
- Zijn Lily Pads autotrofe of heterotrofe?
- Wetenschappers maken belangrijke doorbraak op weg naar nieuw superbug-dodend antibioticum teixobactine
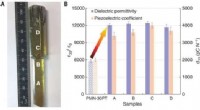
- Onderzoekers ontdekken dat het toevoegen van zeldzame-aarde-elementen aan piëzo-elektrische kristallen de prestaties drastisch verbetert
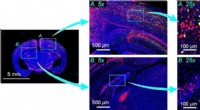
- Wetenschappers identificeren schadelijke bacteriën op basis van hun DNA tegen zeer lage kosten

- Optisch beeldvormingssysteem kan een ongekend aantal cellen in een enkele afbeelding vastleggen
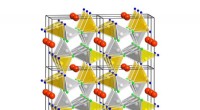
- Een nieuwe energiebesparende LED-fosfor
 Waarom hebben W tegelijkertijd verschillende temperatuur in delen van de wereld?
Waarom hebben W tegelijkertijd verschillende temperatuur in delen van de wereld?  Drie stappen naar veiligere en degelijkere software
Drie stappen naar veiligere en degelijkere software Kleine tuin? Geen probleem! Onderzoekers bewijzen dat miniweiden rijke leefgebieden kunnen vormen voor bestuivers
Kleine tuin? Geen probleem! Onderzoekers bewijzen dat miniweiden rijke leefgebieden kunnen vormen voor bestuivers Hoe vinden vogels vogelvoeders?
Hoe vinden vogels vogelvoeders?  Kunnen megatesla magnetische velden op aarde worden gerealiseerd?
Kunnen megatesla magnetische velden op aarde worden gerealiseerd?  Hoe gebruiken biologen wetenschappelijke notatie?
Hoe gebruiken biologen wetenschappelijke notatie?  Wie publiceerde een boek waarin de heliocentrische theorie wordt uiteengezet?
Wie publiceerde een boek waarin de heliocentrische theorie wordt uiteengezet?  Hoe kan een organisme in het vierde tropische niveau energie verkrijgen van de zon?
Hoe kan een organisme in het vierde tropische niveau energie verkrijgen van de zon?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

