
Wetenschap
Hoe kunnen ionen worden beschreven?
Basisbeschrijving:
* geladen atomen of moleculen: Ionen zijn atomen of moleculen die elektronen hebben gewonnen of verloren, wat resulteert in een netto elektrische lading.
* kationen versus anionen:
* kationen zijn positief geladen ionen gevormd wanneer een atoom elektronen verliest.
* anionen zijn negatief geladen ionen gevormd wanneer een atoom elektronen krijgt.
* ionische bindingen: Ionen vormen vaak ionische bindingen met tegengesteld geladen ionen, waardoor ionische verbindingen ontstaan.
Meer gedetailleerde beschrijving:
* opladen: De lading van een ion wordt weergegeven door een superscriptnummer gevolgd door een plus- of min -teken. Na + heeft bijvoorbeeld een +1 lading, terwijl Cl- een -1 -lading heeft.
* Grootte: Ionen zijn over het algemeen kleiner dan hun neutrale atomen. Kationen zijn kleiner dan hun overeenkomstige neutrale atomen omdat ze elektronen hebben verloren, terwijl anionen groter zijn omdat ze elektronen hebben gewonnen.
* Reactiviteit: Ionen zijn zeer reactief vanwege hun onevenwichtige aanklachten. Ze hebben de neiging om deel te nemen aan chemische reacties om een stabiele elektronische configuratie te bereiken.
* typen: Ionen kunnen in verschillende typen worden ingedeeld op basis van hun lading, grootte en chemische eigenschappen. Er zijn bijvoorbeeld monoatomische ionen (gevormd uit enkele atomen) en polyatomische ionen (gevormd uit groepen atomen).
Voorbeelden:
* Natriumion (Na+): Een positief geladen ion gevormd wanneer een natriumatoom één elektron verliest.
* chloride-ion (Cl-): Een negatief geladen ion gevormd wanneer een chlooratoom één elektron krijgt.
* calciumion (Ca2+): Een positief geladen ion gevormd wanneer een calciumatoom twee elektronen verliest.
* Hydroxide-ion (OH-): Een negatief geladen polyatomisch ion gevormd door een waterstofatoom en een zuurstofatoom.
Key Concepts:
* elektronegativiteit: Het vermogen van een atoom om elektronen aan te trekken in een chemische binding. Hogere elektronegativiteit maakt het voor een atoom gemakkelijker om elektronen te krijgen en een anion te vormen.
* Elektronenconfiguratie: De opstelling van elektronen in een atoom. Ionen streven ernaar om een stabiele elektronenconfiguratie te bereiken, die meestal op die van een edelgas lijken.
Inzicht in deze beschrijvingen helpt u de aard en het gedrag van ionen in verschillende chemische processen te begrijpen.
 Welke chemische stof wordt gebruikt voor de detectie van sulfaat in waterige oplossing?
Welke chemische stof wordt gebruikt voor de detectie van sulfaat in waterige oplossing?  Welke materialen maakten scheikundigen in laboratoria?
Welke materialen maakten scheikundigen in laboratoria?  Optische interferometrie visualiseert hoe vaak lelies vluchtige organische stoffen uitstoten
Optische interferometrie visualiseert hoe vaak lelies vluchtige organische stoffen uitstoten  Waarom zout in boter steken?
Waarom zout in boter steken?  Een nieuwe neusachtige sensor snuift giftig ammoniakgas op
Een nieuwe neusachtige sensor snuift giftig ammoniakgas op
 Onderwaterafval vertroebelt de hoop op duurzame diepzeemijnbouw
Onderwaterafval vertroebelt de hoop op duurzame diepzeemijnbouw Overstroming van Parijs grijpt terug op een van de grote doorbraken in de hydrologie
Overstroming van Parijs grijpt terug op een van de grote doorbraken in de hydrologie Welke soorten planten leven er in de jungle?
Welke soorten planten leven er in de jungle?  Waarom we temperatuuroverschrijding in het klimaatbeleid moeten voorkomen
Waarom we temperatuuroverschrijding in het klimaatbeleid moeten voorkomen Tropische cycloon Gaja nadert Zuidoost-India
Tropische cycloon Gaja nadert Zuidoost-India
Hoofdlijnen
- Wat is de functie van Brunner -klier?
- Het gebruik van het referentiegenoom van de soort zelf is optimaal voor SNP-aanroepen, zo blijkt uit onderzoek
- Wat heeft wetenschapper Linnaeus bijgedragen aan de plantkunde?
- Welke van de volgende is een meest voorkomende pathogene micro -organismen in Amerikaanse voedingsmiddelen?
- Wat zijn toepassingen van mitose en meoisis?
- Teams van sperma zwemmen soepeler tegen de stroom in
- Wat is een protist die flagellum gebruikt om te verplaatsen?
- Het aantal genen in de mens is slechts 30000, maar het maakt miljoenen eiwitten hoe?
- Nieuw inzicht in hoe delende cellen de scheiding van hun DNA controleren
- Nieuwe MD-simulatie werpt licht op het mysterie van de structuur van gehydrateerde elektronen

- Omgedraaide metaaloxide kooi kan kooldioxide scheiden van koolmonoxide
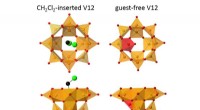
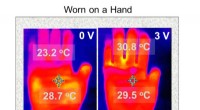
- Elektrisch verwarmd textiel nu mogelijk
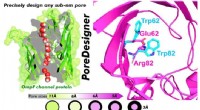
- PoreDesigner verbetert het ontwerp van eiwitkanalen voor waterbehandeling, bioscheidingen
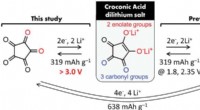
- Een 4 V-klasse metaalvrije organische lithium-ionbatterij komt dichter bij de realiteit
 Bereken gemiddelde afwijking
Bereken gemiddelde afwijking Wat is de samenstelling van gassen in buislichten?
Wat is de samenstelling van gassen in buislichten?  Omnivoren van de toendra
Omnivoren van de toendra  Welke reproductie geeft planten meer variatie?
Welke reproductie geeft planten meer variatie?  Waarom gebruiken we atomaire energie?
Waarom gebruiken we atomaire energie?  Hoeveel kracht is er nodig om een wagen van 6 kg in 5 seconden vanuit een rustsnelheid van 10 m per seconde te laten accelereren?
Hoeveel kracht is er nodig om een wagen van 6 kg in 5 seconden vanuit een rustsnelheid van 10 m per seconde te laten accelereren?  Welke zouten krijg je in HNO3?
Welke zouten krijg je in HNO3?  Nanomagneten zuiveren bloed
Nanomagneten zuiveren bloed
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

