
Wetenschap
Wat gebeurt er met water als u er zout in stopt?
1. Oplossen:
* Zout (natriumchloride) is een kristallijne vaste stof. Wanneer je het in water legt, omringen de watermoleculen de zoutkristallen.
* De positieve uiteinden van watermoleculen (waterstofatomen) worden aangetrokken door de negatief geladen chloride -ionen in het zout.
* De negatieve uiteinden van watermoleculen (zuurstofatomen) worden aangetrokken door de positief geladen natriumionen in het zout.
* Deze aantrekkingskracht verbreekt de bindingen die de zoutkristallen bij elkaar houden, waardoor ze oplossen.
2. Oplossingsvorming:
* De opgeloste zoutionen (natrium en chloride) worden omgeven door watermoleculen en vormen een oplossing.
* De oplossing is nu een homogeen mengsel, wat betekent dat het zout gelijkmatig over het water wordt verdeeld.
3. Veranderingen in eigenschappen:
* kookpunt: Het kookpunt van het water neemt toe. Hoe meer zout je toevoegt, hoe hoger het kookpunt.
* vriespunt: Het vriespunt van het water neemt af. Hoe meer zout je toevoegt, hoe lager het vriespunt.
* Dichtheid: De dichtheid van het water neemt toe. Zout water is dichter dan zoet water.
* geleidbaarheid: De oplossing wordt elektrisch geleidend omdat de opgeloste ionen een elektrische stroom kunnen dragen.
Samenvattend:
Door zout aan water toe te voegen zorgt ervoor dat het zout oplost, waardoor een oplossing met verschillende eigenschappen ontstaat in vergelijking met zuiver water.
 Wat is een voorbeeld van een vloeibaar-gasoplossing, en welke gas-gasoplossing?
Wat is een voorbeeld van een vloeibaar-gasoplossing, en welke gas-gasoplossing?  Behoort boor tot de metaalfamilie?
Behoort boor tot de metaalfamilie?  Wat is de verbinding die nodig is om ijzer roest te maken?
Wat is de verbinding die nodig is om ijzer roest te maken?  Hoe is een zeer waarschijnlijke oxidatietoestand gerelateerd aan zijn valentie -elektronen?
Hoe is een zeer waarschijnlijke oxidatietoestand gerelateerd aan zijn valentie -elektronen?  Welke twee verbindingen zijn elektrolyten?
Welke twee verbindingen zijn elektrolyten?
 Wat zijn enkele interessante feiten over Stratus Clouds?
Wat zijn enkele interessante feiten over Stratus Clouds?  Op welke twee manieren helpt sneeuw planten?
Op welke twee manieren helpt sneeuw planten?  Laat kommer en kwel vallen:klimaatjournalistiek gaat over empowerment
Laat kommer en kwel vallen:klimaatjournalistiek gaat over empowerment Verrassing door klimaatverandering:het helpt meer maïs en sojabonen te verbouwen in de Upper Midwest
Verrassing door klimaatverandering:het helpt meer maïs en sojabonen te verbouwen in de Upper Midwest La Palma eilanden vulkaan brult weer, dikkere lava spuwen
La Palma eilanden vulkaan brult weer, dikkere lava spuwen
Hoofdlijnen
- Waarom stak de olifant de weg over? In Maleisië, ze proberen het antwoord te vinden
- De locaties A P en E worden bezet door aminozuren die worden geassembleerd in een keten van polypeptide waar ze deel van uitmaken?
- Bij het taggen van dieren specifiek voor de studie van populatiegrootte moet wetenschappers alles volgen, behalve?
- Wat is celcompartimentering en waarom doet het zich voor?
- Welke suiker heeft RNA dat anders is dan het in DNA?
- Hoe wordt recombinant DNA gemaakt?
- Wat is bio -meststof?
- Hoe breidt DNA uit?
- Welke structuur wordt aangetroffen in zowel dier- als plantencel?
- Vooruitgang in gefuseerde-ringelektronenacceptoren
- Onderzoekers ontdekken dat ruimte tussen polymeerketens de energieconversie beïnvloedt

- Wetenschappers vinden zelfherstellende katalysator voor mogelijk grootschalig gebruik bij waterstofproductie
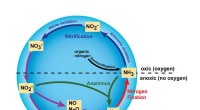
- De fijne kneepjes van de stikstofcyclus onderzoeken
- Nieuwe strategie zorgt voor efficiënte en stabiele elektrolyse van kooldioxide in elektrolysecel voor vaste oxiden

 Wat zorgt ervoor dat een zonnevran in eerste instantie begint met zonne -energie?
Wat zorgt ervoor dat een zonnevran in eerste instantie begint met zonne -energie?  Embryonale ontwikkeling van een kikker
Embryonale ontwikkeling van een kikker  Bosbranden in Zuid-Afrika zullen toenemen:hoe juridische stappen het land kunnen helpen zich beter aan te passen aan de klimaatverandering
Bosbranden in Zuid-Afrika zullen toenemen:hoe juridische stappen het land kunnen helpen zich beter aan te passen aan de klimaatverandering  Wat zijn enkele geografische kenmerken van Latijns -Amerika?
Wat zijn enkele geografische kenmerken van Latijns -Amerika?  Roofdier en prooi in cyberstasis
Roofdier en prooi in cyberstasis Waarom wordt tin gebruikt?
Waarom wordt tin gebruikt?  Hoeveel van de planeten tot zon?
Hoeveel van de planeten tot zon?  De geboorte en dood van een fonon detecteren
De geboorte en dood van een fonon detecteren
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

