
Wetenschap
Wat is de edelgasconfiguratie van Boron?
1. Zoek het atoomnummer van Boron:
* Boron heeft een atoomnummer van 5, wat betekent dat het 5 protonen en 5 elektronen heeft.
2. Identificeer het vorige edelgas:
* Het vorige edelgas op het periodieke tabel is helium (hij), dat een atoomnummer van 2 heeft.
3. Bepaal de resterende elektronen:
* Boron heeft 5 elektronen en helium heeft 2 elektronen. Trek het aantal elektronen in helium af van het aantal elektronen in boor:5 - 2 =3 elektronen.
4. Schrijf de adellijke gasconfiguratie:
* De edelgasconfiguratie van boor is [He] 2S² 2p¹
Verklaring:
* [hij] vertegenwoordigt de gevulde elektronenconfiguratie van helium.
* 2s² Geeft aan dat de 2S -subshell 2 elektronen bevat.
* 2p¹ geeft aan dat de 2P -subshell 1 elektron bevat.
 Wat is kleiner dan een atoom?
Wat is kleiner dan een atoom?  De zoete smaak van innovatie
De zoete smaak van innovatie Onderzoekers helpen de wet van Moore bij te houden door een nieuwe materiaalklasse te verkennen
Onderzoekers helpen de wet van Moore bij te houden door een nieuwe materiaalklasse te verkennen fysieke eigendom dat wordt gedeeld door goud en koper, maar niet door ijzer?
fysieke eigendom dat wordt gedeeld door goud en koper, maar niet door ijzer?  Traditionele Chinese geneeskrachtige plant levert nieuwe insecticiden op
Traditionele Chinese geneeskrachtige plant levert nieuwe insecticiden op
 Vulkanische bogen worden gevormd door het diep smelten van gesteentemengsels
Vulkanische bogen worden gevormd door het diep smelten van gesteentemengsels Basisovertuigingen van de Bora-indianen
Basisovertuigingen van de Bora-indianen Een kwestie van zwaartekracht:begrijpen hoe planten in de ruimte groeien
Een kwestie van zwaartekracht:begrijpen hoe planten in de ruimte groeien  Rollen van cyanobacteriën in het ecosysteem
Rollen van cyanobacteriën in het ecosysteem Hoe slecht zijn invasieve planten voor vogels? Uit onderzoek blijkt dat grootschalige verwijdering mogelijk geen beoogde voordelen heeft
Hoe slecht zijn invasieve planten voor vogels? Uit onderzoek blijkt dat grootschalige verwijdering mogelijk geen beoogde voordelen heeft
Hoofdlijnen
- Wie heeft de term biotechnologie bedacht?
- Beweeglijke bacteriën bewegen door middel van?
- Stamcellen die vetweefsel genereren, hebben een circadiane klok
- Hier ziet u hoe genetica heeft bijgedragen aan het ontrafelen van de geschiedenis van menselijke migratie
- Waarom zijn ontleders weggelaten uit bijna alle diagrammen voedselketens en -wB's?
- Bevordering van de veerkracht van fruitgewassen:onthulling van de moleculaire dynamiek van abscissie in houtachtige fruitgewassen
- Kun je bepalen of een organisme een suiker kan fermenteren als het niet in bouillon groeit?
- Wat is recombinatie?
- Wat is er een onafhankelijk of afzonderlijk bestaan?
- Op koolstof gebaseerde katalysatoren die worden gebruikt voor Fischer-Tropsch-synthese
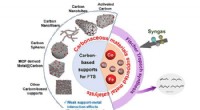
- Beeldvorming van de chemische structuur van individuele moleculen, atoom voor atoom

- Metabolische activiteit van bruin vetweefsel gemakkelijker te verifiëren met nieuwe methode

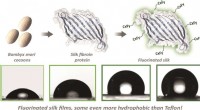
- Wetenschappers gebruiken gemodificeerde zijde-eiwitten om nieuwe anti-aanbakoppervlakken te creëren
- Nieuwe bacteriële testmethode om de gezondheidszorg te verbeteren, voedselveiligheid en meer
 Wat 'naar rechts vegen' met je kan doen
Wat 'naar rechts vegen' met je kan doen  Kennis kristalliseren met een leermachine
Kennis kristalliseren met een leermachine Studie bevestigt bliksem krachtiger over oceaan dan over land
Studie bevestigt bliksem krachtiger over oceaan dan over land Wat kan er gebeuren als twee oceaanplaten samenkomen en één wordt onderworpen aan de mantel?
Wat kan er gebeuren als twee oceaanplaten samenkomen en één wordt onderworpen aan de mantel?  Computermodellen laten een aanzienlijke tsunamisterkte zien voor Ventura en Oxnard
Computermodellen laten een aanzienlijke tsunamisterkte zien voor Ventura en Oxnard  Het helderste object in het heelal is een zwart gat dat elke dag een ster opeet
Het helderste object in het heelal is een zwart gat dat elke dag een ster opeet  Iran verbiedt overheidsinstanties om apps voor buitenlandse berichten te gebruiken
Iran verbiedt overheidsinstanties om apps voor buitenlandse berichten te gebruiken HL-LHC-magneetduurzaamheidstest bevestigt verder de veerkracht van niobium–tins
HL-LHC-magneetduurzaamheidstest bevestigt verder de veerkracht van niobium–tins
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

