
Wetenschap
Een wetenschapper wil testen hoeveel van een zuur een oplossing kan worden toegevoegd voordat de pH onder een bepaald punt verandert. Het begin is 6.0 en wil?
Inzicht in het experiment
De wetenschapper is geïnteresseerd in de bufferingscapaciteit van een oplossing. Een buffer is een oplossing die weerstand biedt aan veranderingen in de pH wanneer een zuur of base wordt toegevoegd. Het vermogen van een oplossing voor buffer hangt af van de aanwezigheid van een zwak zuur en de conjugaatbasis (of een zwakke basis en het conjugaatzuur).
Experimentele opstelling
1. De oplossing: De wetenschapper moet de exacte samenstelling van de startoplossing kennen. Dit is cruciaal omdat het buffercapaciteit afhankelijk is van de specifieke aanwezige chemicaliën.
2. het zuur: De wetenschapper moet een specifiek zuur voor het experiment kiezen. De sterkte van het zuur (hoe gemakkelijk het doneert, zal de protonen doneren) beïnvloeden de snelheid van pH -verandering.
3. De doel -pH: De wetenschapper definieert een specifieke pH -waarde waaronder ze niet willen dat de oplossing daalt.
4. Titratie: Het experiment zou een titratie inhouden. Dit betekent dat de zuurdruppelsgewijs aan de oplossing wordt toegevoegd en de pH zorgvuldig moet bewaken met behulp van een pH -meter.
Gegevensverzameling en -analyse
1. pH -metingen: Noteer de pH van de oplossing met regelmatige intervallen als het zuur wordt toegevoegd.
2. Eindpunt: Het eindpunt is het punt waarop de pH onder de doelwaarde daalt. Let op het volume zuur dat op dit punt is toegevoegd.
3. Berekening: De wetenschapper kan de hoeveelheid zuur berekenen die kan worden toegevoegd voordat de pH onder het doel valt. Deze informatie zal worden gebruikt om de buffercapaciteit van de oorspronkelijke oplossing te bepalen.
Voorbeeld
Laten we zeggen dat de startoplossing een buffer is met een pH van 6,0. De wetenschapper wil weten hoeveel zoutzuur (HCL) kan worden toegevoegd voordat de pH onder 5,5 daalt. Hier is een vereenvoudigd scenario:
* Start: De oplossing heeft een pH van 6,0.
* titratie: De wetenschapper voegt zorgvuldig kleine hoeveelheden HCL toe terwijl de pH wordt bewaakt.
* eindpunt: De pH daalt onder 5,5 na 10 ml HCl wordt toegevoegd.
* Conclusie: Deze oplossing kan de toevoeging van 10 ml HCl verdragen voordat de pH onder het gewenste niveau daalt.
Key Concepts
* pH: Een maat voor de zuurgraad of alkaliteit van een oplossing. Lagere pH -waarden duiden op een hogere zuurgraad.
* Bufferingscapaciteit: Het vermogen van een oplossing om veranderingen in pH te weerstaan wanneer een zuur of base wordt toegevoegd.
* titratie: Een techniek die wordt gebruikt om de concentratie van een stof te bepalen door deze te reageren met een oplossing van bekende concentratie.
belangrijke overwegingen
* Het juiste zuur kiezen: De keuze van zuur hangt af van de specifieke onderzoeksvraag.
* Temperatuur regelen: Temperatuur kan de pH van oplossingen beïnvloeden, dus het experiment houden op een consistente temperatuur is belangrijk.
* Resultaten interpreteren: De resultaten geven de wetenschapper informatie over de buffercapaciteit van de startoplossing, maar ze zullen hen niet noodzakelijk de exacte chemische samenstelling van de oplossing vertellen.
Laat het me weten als je nog andere vragen hebt over het experiment of verdere opheldering nodig hebt!
 Wat is het atoomnummer van hout?
Wat is het atoomnummer van hout?  Wat is de vuistregel voor het bepalen van het aantal covalente bindingen dat een atoom kan uitvoeren?
Wat is de vuistregel voor het bepalen van het aantal covalente bindingen dat een atoom kan uitvoeren?  Wat in huis neutraliseert zwavelzuur?
Wat in huis neutraliseert zwavelzuur?  Zorgt zout dat aan water wordt toegevoegd ervoor dat het water sneller opwarmt dan zonder water, en als beide worden verwarmd, kookt het?
Zorgt zout dat aan water wordt toegevoegd ervoor dat het water sneller opwarmt dan zonder water, en als beide worden verwarmd, kookt het?  Welke eigenschappen hebben niet -metalen gemeen?
Welke eigenschappen hebben niet -metalen gemeen?
Hoofdlijnen
- Hoe noem je een organisme met kern?
- Kunnen taalmodellen het genoom lezen? Deze decodeerde mRNA om betere vaccins te maken
- Onderzoekers vinden dat RNA-bewerkingssites waarschijnlijk een belangrijkere rol spelen bij genetische ziekten
- Wat is osmose actief of passief?
- Hoe creoolse talen evolueren, kan afhangen van hoe mensen ze begonnen te gebruiken
- Wat was er eerst:het hoofd of de hersenen?
- Wat gebeurt er als mitose verkeerd gaat?
- Wat is een polycule? Een expert op het gebied van polyamorie legt het uit
- Welke monosacharide zit in fruit?
- Een Trojaanse paardenbenadering kan leiden tot behandelingen voor sommige antibioticaresistente bacteriën
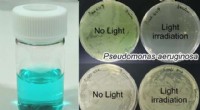
- Het lichaam vertrouwt op duizenden suiker-eiwitcomplexen om gezond te blijven
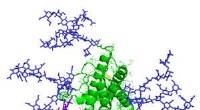
- Wat zit er achter stinkende wijn?

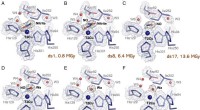
- Moleculaire films werpen licht op het enzym dat betrokken is bij de productie van broeikasgassen
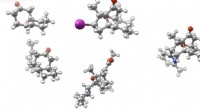
- Chemici synthetiseren psychotrope verbindingen uit regenwoudboom
 Het recht om de verbinding te verbreken komt in Australië – wat betekent dit voor u?
Het recht om de verbinding te verbreken komt in Australië – wat betekent dit voor u?  Welk nummerbereik kun je een zuur-in op de pH-schaal vinden?
Welk nummerbereik kun je een zuur-in op de pH-schaal vinden?  Is Mount Longonot een uitgestorven vulkaan?
Is Mount Longonot een uitgestorven vulkaan?  Een nieuwe methode voor de snelle detectie van een belangrijke antivirale
Een nieuwe methode voor de snelle detectie van een belangrijke antivirale Onderzoekers onthullen skyrmion-fysica aangedreven door magnonen in beperkte geometrieën
Onderzoekers onthullen skyrmion-fysica aangedreven door magnonen in beperkte geometrieën Op weg naar een planetarium voor de kwantummetertheorie
Op weg naar een planetarium voor de kwantummetertheorie Renault-baas vecht om autofabrikant op koers te houden
Renault-baas vecht om autofabrikant op koers te houden Sponsachtige elektroden geïnspireerd op suikerklontjes kunnen medische monitoring verbeteren
Sponsachtige elektroden geïnspireerd op suikerklontjes kunnen medische monitoring verbeteren
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

