
Wetenschap
Wat is niet -beperkende reactant uitgelegd met een geschikt voorbeeld?
De niet-beperkende reactant:degene die blijft geven
In een chemische reactie, de beperkende reactant is degene die eerst volledig wordt opgebruikt, waardoor de hoeveelheid product wordt beperkt die kan worden gevormd. De niet-beperkende reactant , aan de andere kant, is degene die overblijft nadat de reactie is voltooid.
Zie het als een cake bakken:
* bloem Is uw beperkende reactant. Als je geen bloem meer hebt, kun je geen cake meer maken, ongeacht hoeveel suiker of eieren je nog hebt.
* Sugar Is uw niet-beperkingreactant. Je hebt misschien veel suikerresten, maar je kunt niet meer cake maken zonder bloem.
Hier is een chemisch voorbeeld:
Stel je voor dat we reageren waterstof (H2) en zuurstof (O2) om water (H2O) te vormen :
2 H2 + O2 → 2 H2O
Laten we zeggen dat we beginnen met 2 mol waterstof en 1 mol zuurstof.
* waterstof (H2) is de beperkende reactant: Dit komt omdat de reactie 2 mol waterstof nodig heeft voor elke 1 mol zuurstof. Omdat we slechts 1 mol zuurstof hebben, kunnen we slechts 2 mol waterstof gebruiken om volledig te reageren met de beschikbare zuurstof.
* zuurstof (O2) is de niet-beperkte reactant: We hebben 0,5 mol zuurstof over nadat alle waterstof is opgebruikt.
Key Takeaway:
De niet-beperkende reactant is als de extra ingrediënten die je na een reactie hebt overgebleven. Hoewel het belangrijk is dat de reactie opkomt, bepaalt dit niet hoeveel product wordt gevormd. De hoeveelheid product wordt uitsluitend bepaald door de hoeveelheid beperkende reactant.
Waarom het ertoe doet:
Inzicht in de beperkende reactant is cruciaal in de chemie omdat het ons helpt:
* Bereken de theoretische opbrengst van een reactie
* Bepaal hoeveel product kan worden gevormd uit een bepaalde reeks reactanten
* Optimaliseer chemische reacties door ervoor te zorgen dat alle reactanten efficiënt worden gebruikt
Kortom, de niet-beperkende reactant is degene die de uitkomst van de reactie niet beheerst, maar het is nog steeds een cruciaal onderdeel van het proces.
 De mysterieuze D-laag van de aarde:een overblijfsel van oude oceanen en planetaire botsingen
De mysterieuze D-laag van de aarde:een overblijfsel van oude oceanen en planetaire botsingen  aardbeving met een kracht van 6,3 op de schaal van Richter ten zuiden van Bali in Indonesië
aardbeving met een kracht van 6,3 op de schaal van Richter ten zuiden van Bali in Indonesië Feiten over meelwormen voor kinderen
Feiten over meelwormen voor kinderen  Een moordende elektronenhotspot vinden in de Van Allen-stralingsgordels van de aarde
Een moordende elektronenhotspot vinden in de Van Allen-stralingsgordels van de aarde Opinie:Maatregelen van armoede en welzijn negeren nog steeds het milieu – dit moet veranderen
Opinie:Maatregelen van armoede en welzijn negeren nog steeds het milieu – dit moet veranderen
Hoofdlijnen
- Wat vormt een koninkrijk van eencellige organismen zonder kern?
- Wat zijn de voordelen van een mariene bioloog?
- Hoogvliegend experiment:groeien stamcellen beter in de ruimte?
- Onderzoekers ontwikkelen een algoritme om te bepalen hoe cellulaire ‘buurten’ in weefsels functioneren
- Kan plastic gemaakt worden van algen?
- Wat is een aanpassing voor Dahlia?
- Binaire splijting: definitie & proces
- Hoe werkt DNA-vertaling?
- Telofase: wat gebeurt er in deze fase van mitose en meiose?
- Verbindingen in monsterradijs kunnen hart- en vaatziekten helpen temmen
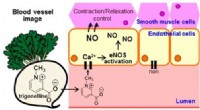
- Onderzoekers beschrijven structuren, mechanismen die bacteriën in staat stellen antibiotica te weerstaan

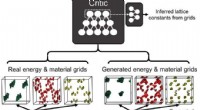
- Omgekeerd ontwerp van poreuze materialen met behulp van kunstmatige neurale netwerken
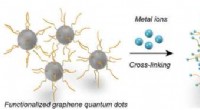
- Quantum dots houden atomen op afstand om katalyse te stimuleren
- Doorbraak in het benutten van de kracht van biologische katalysatoren

 Wat doet het diafragma op een microscoop?
Wat doet het diafragma op een microscoop?  Zelfverdichtend beton wordt duurzamer door gebruik van granietresten
Zelfverdichtend beton wordt duurzamer door gebruik van granietresten De allereerste vrijgave van GPS-gegevens om de wetenschap over het ruimteweer een boost te geven
De allereerste vrijgave van GPS-gegevens om de wetenschap over het ruimteweer een boost te geven Een wiskundig patroon oplossen
Een wiskundig patroon oplossen Noem de vijf lagen van atmosfeer en omstandigheden?
Noem de vijf lagen van atmosfeer en omstandigheden?  Eerste blauwdruk ooit onthuld om een grootschalige kwantumcomputer te bouwen
Eerste blauwdruk ooit onthuld om een grootschalige kwantumcomputer te bouwen De afgelopen 12.000 jaar laten een complexere klimaatgeschiedenis zien dan eerder werd gedacht
De afgelopen 12.000 jaar laten een complexere klimaatgeschiedenis zien dan eerder werd gedacht  Waarom vindt er een kleurverandering plaats tijdens het titreren van zout tegen kaliumdichromaat?
Waarom vindt er een kleurverandering plaats tijdens het titreren van zout tegen kaliumdichromaat?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

