
Wetenschap
Hoeveel gram stoom wordt ongeveer uit 25 gram water gevormd?
* Faseverandering: Wanneer water in stoom verandert (waterdamp), is dit geen chemische verandering, maar een fysieke verandering van toestand. De watermoleculen zelf veranderen niet, alleen hun opstelling en energieniveaus.
* Energie -eis: Om van water in stoom te veranderen, moet u voldoende energie (warmte) toevoegen om de krachten te overwinnen die de watermoleculen bij elkaar houden. Dit wordt de verdampingswarmte genoemd.
* variabele warmte -ingang: De gevormde hoeveelheid stoom is afhankelijk van de hoeveelheid toegevoegde warmte -energie.
Hier is hoe u dit zou kunnen uitzoeken:
1. Warmte -invoer: Je moet weten hoeveel warmte -energie wordt toegevoegd aan de 25 gram water.
2. VAIDWANDSTELIJKING: De verdampingswarmte voor water is ongeveer 2260 J/g. Dit betekent dat er 2260 joules van energie nodig zijn om 1 gram water om te zetten in stoom.
3. Berekening: U kunt vervolgens de massa van stoom berekenen die wordt geproduceerd door de totale warmte -energie te delen die wordt toegevoegd door de verdampingswarmte.
Voorbeeld:
Laten we zeggen dat u 50.000 joulen warmte toevoegt aan 25 gram water.
* Mass van stoom: (50.000 J) / (2260 J / G) =22,12 gram stoom
Belangrijke opmerking: Dit is een vereenvoudigd voorbeeld. In werkelijkheid zijn er factoren zoals druk en temperatuur die de hoeveelheid geproduceerde stoom kunnen beïnvloeden.
 Wat is het verschil tussen een oplosmiddel en verdunningsmiddel?
Wat is het verschil tussen een oplosmiddel en verdunningsmiddel?  Nieuw inzicht in celmembranen kan het testen en ontwerpen van geneesmiddelen verbeteren
Nieuw inzicht in celmembranen kan het testen en ontwerpen van geneesmiddelen verbeteren Welke combinatie van verschillende stoffen die hetzelfde individu blijven en op fysieke middelen kunnen worden gescheiden?
Welke combinatie van verschillende stoffen die hetzelfde individu blijven en op fysieke middelen kunnen worden gescheiden?  Kunnen we materie vervaardigen?
Kunnen we materie vervaardigen?  Branden alle zuren door dingen heen?
Branden alle zuren door dingen heen?
 Een nieuwe methode om de voorspellingen van de intensiteit van tropische cyclonen te verbeteren
Een nieuwe methode om de voorspellingen van de intensiteit van tropische cyclonen te verbeteren AI-weersvoorspellingen kunnen het destructieve pad van grote stormen vastleggen, blijkt uit nieuw onderzoek
AI-weersvoorspellingen kunnen het destructieve pad van grote stormen vastleggen, blijkt uit nieuw onderzoek  Basisweerinstrumenten
Basisweerinstrumenten  Golfkust bretels, opnieuw, voor orkaan terwijl Zeta mikt
Golfkust bretels, opnieuw, voor orkaan terwijl Zeta mikt Projecties van Antarctisch ijsverlies en wereldwijde zeespiegelstijging verfijnen
Projecties van Antarctisch ijsverlies en wereldwijde zeespiegelstijging verfijnen
Hoofdlijnen
- Wat is ureum?
- Transformatief onderzoek onrealistisch om te voorspellen, wetenschappers vertellen subsidieverstrekkers
- Wat produceert in de hersenen secreties die de lichaamsfunctie regelen?
- Zijn gelukkige mensen gezonder?
- Waar wordt aminozuursequentie gevormd?
- Zijn de meeste dierengameten diploïde of haploïde?
- Uitkomsten van ziekten verschillen per nieuwe gastheersoort in experimenten met virusspillover
- Wat wordt ook wel amylose genoemd en wordt door planten gebruikt om glucose op te slaan?
- Hoeveel letters in de code voor eiwitten en hoe worden ze genoemd?
- Reactie voegt chirale groepen toe aan stikstofringen zonder eerst reactieve groepen te installeren

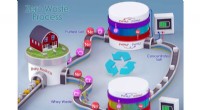
- Minder zout, meer eiwit:aanpak van zuivelverwerking, milieu, duurzaamheidskwesties
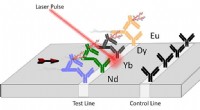
- Nieuwe technologie voor detectie van pathogenen aangedreven door lasers
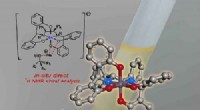
- Onderzoekers vinden een betere manier om metaallegeringen te ontwerpen

- Op gallium gebaseerd oplosmiddel analyseert efficiënt optisch actieve alcoholen
 De volgende generatie triggers voor CERN-detectoren
De volgende generatie triggers voor CERN-detectoren  Een miljoen keer sneller:DNA-nanotechnologie kan de farmaceutische ontwikkeling versnellen en tegelijkertijd de kosten minimaliseren
Een miljoen keer sneller:DNA-nanotechnologie kan de farmaceutische ontwikkeling versnellen en tegelijkertijd de kosten minimaliseren Hoe een Math Compass
Hoe een Math Compass Krachten van de draaiing van de aarde kunnen aardbevingen en vulkaanuitbarstingen veroorzaken op de Etna
Krachten van de draaiing van de aarde kunnen aardbevingen en vulkaanuitbarstingen veroorzaken op de Etna Wetenschappers ontdekken hoe de grootste vulkanen ter wereld zijn ontstaan
Wetenschappers ontdekken hoe de grootste vulkanen ter wereld zijn ontstaan  Nieuw rapport onderzoekt belemmeringen voor werkgelegenheid voor vluchtelingen en asielmigranten
Nieuw rapport onderzoekt belemmeringen voor werkgelegenheid voor vluchtelingen en asielmigranten Uit peilingen blijkt dat er een enorme kloof bestaat tussen wat het publiek, wetenschappers, denkt
Uit peilingen blijkt dat er een enorme kloof bestaat tussen wat het publiek, wetenschappers, denkt  Begrijpen waarom een versneller een snelheidsverandering veroorzaakt?
Begrijpen waarom een versneller een snelheidsverandering veroorzaakt?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

