
Wetenschap
Zijn hydrofiele stoffen aangetrokken tot water?
Dit is waarom:
* polariteit: Hydrofiele stoffen zijn typisch polair, wat betekent dat ze een ongelijke verdeling van elektrische lading in hun moleculen hebben. Dit creëert gebieden van gedeeltelijke positieve en gedeeltelijke negatieve lading, vergelijkbaar met watermoleculen, die ook polair zijn.
* waterstofbinding: Door de gedeeltelijke ladingen op hydrofiele moleculen kunnen ze waterstofbruggen vormen met watermoleculen. Deze sterke interacties zijn de belangrijkste reden voor aantrekkingskracht tussen hydrofiele stoffen en water.
Voorbeelden van hydrofiele stoffen omvatten:
* suikers: Net als glucose hebben ze veel polaire hydroxylgroepen die gemakkelijk waterstofbruggen met water vormen.
* zouten: Zouten zoals natriumchloride (NaCl) dissociëren in ionen in water en vormen sterke elektrostatische interacties.
* Veel eiwitten en aminozuren: Bevat polaire zijketens die interageren met water.
daarentegen worden hydrofobe stoffen afgestoten door water. Ze zijn meestal niet-polair en vormen geen waterstofbruggen met watermoleculen.
 Bij gebruik van papierchromatografie om schermmethyloranje te scheiden en welke beweegt het verste op papier?
Bij gebruik van papierchromatografie om schermmethyloranje te scheiden en welke beweegt het verste op papier?  Welk volume oplosmiddel moet worden toegevoegd aan 36,8 g CH3OH om een 0,500 M oplossing CH3OH te verkrijgen?
Welk volume oplosmiddel moet worden toegevoegd aan 36,8 g CH3OH om een 0,500 M oplossing CH3OH te verkrijgen?  Wat is een algemene vorm van ontledingsreactie?
Wat is een algemene vorm van ontledingsreactie?  Synergie voor opslag:al duizenden jaren kernafval bevatten
Synergie voor opslag:al duizenden jaren kernafval bevatten Onderzoek toont spontane zelforganisatie van microdruppels aan door middel van quasi eendimensionale opsluiting
Onderzoek toont spontane zelforganisatie van microdruppels aan door middel van quasi eendimensionale opsluiting
Hoofdlijnen
- Hoe communiceren vogels? Netwerkwetenschapsmodellen openen nieuwe mogelijkheden voor experts
- Hoe genoctrooien werken
- Zijn er mitrocondria in zowel plantaardige als dierlijke cellen?
- Onderzoek toont aan hoe een gen planten helpt hun eiwitproductie in stressvolle tijden te beheersen
- Wat is de functie van een eicel?
- Biogene sedimenten zijn schelpen en skeletten van mariene dierenalgen welke twee voorbeelden dit?
- Waarom de witte vlieg zo'n formidabele bedreiging vormt voor de voedselzekerheid
- Forensische wetenschapsprojecten voor middelbare scholieren
- Waar komt de Fox Glove Plant vandaan?
- Uit de mist:Honingraatfilms
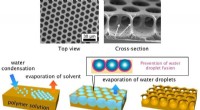
- Kristallisatie bij lage temperatuur van fasezuiver α-formamidiniumloodjodide mogelijk gemaakt door studie

- Nieuwe sensor om atmosferische aerosolen en stikstofdioxide tegelijkertijd te meten
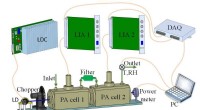
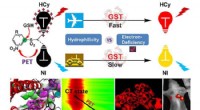
- Elektronendeficiëntie van fluorforen beïnvloedt de herkenningsprestaties van nabij-infrarood fluorescerende sondes
- Patiënten moeten het lab overslaan, krijg onmiddellijke resultaten met nieuwe bloedtesttechnologie

 Wat zijn de verschillende soorten supernova's?
Wat zijn de verschillende soorten supernova's?  Welke stappen worden ondernomen door wetenschappers bij het ontwikkelen van een wetenschappelijke wet of theorie?
Welke stappen worden ondernomen door wetenschappers bij het ontwikkelen van een wetenschappelijke wet of theorie?  Hoe worden kleurpotloden en stiften gemaakt?
Hoe worden kleurpotloden en stiften gemaakt?  Amazon brengt mogelijk een speelgoedcatalogus uit, een vakantietraditie voor het grijpen na het faillissement van Toys R Us
Amazon brengt mogelijk een speelgoedcatalogus uit, een vakantietraditie voor het grijpen na het faillissement van Toys R Us Wat is het principe van fossiele successie?
Wat is het principe van fossiele successie?  Waarom is O2F2 niet stabiel?
Waarom is O2F2 niet stabiel?  Zelfverdichtend beton wordt duurzamer door gebruik van granietresten
Zelfverdichtend beton wordt duurzamer door gebruik van granietresten Onderzoekers volgen de effecten van orkanen op riviervervuiling en nuttige bacteriën
Onderzoekers volgen de effecten van orkanen op riviervervuiling en nuttige bacteriën
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

