
Wetenschap
Gassen zijn goede isolatoren omdat hun moleculen zijn?
Dit is waarom:
* Afstand: De moleculen in een gas liggen veel verder uit elkaar dan in een vloeistof of vaste stof. Dit betekent dat er minder kans is voor de moleculen om te botsen en warmte -energie over te dragen.
* Vrij beweging: Gasmoleculen bewegen willekeurig en hebben geen vaste posities zoals vaste stoffen of vloeistoffen. Dit maakt het moeilijk voor warmte om door het gas over te dragen, omdat de energie constant in willekeurige richtingen wordt verspreid.
daarentegen:
* vaste stoffen: Moleculen zijn strak verpakt en trillen in vaste posities, waardoor een efficiënte warmteoverdracht mogelijk is.
* vloeistoffen: Moleculen zijn dichter bij elkaar dan in een gas, maar hebben meer vrijheid om te bewegen, waardoor warmteoverdracht mogelijk is, maar met meer weerstand dan in vaste stoffen.
Zie het zo:stel je voor dat je een bal door een volle menigte probeert te duwen. Het zou veel moeilijker zijn dan het door een veld te duwen met mensen die ver uit elkaar worden geteisterd!
 Welke organel in planten die het licht absorberende molecuul chlorofie11 bevatten?
Welke organel in planten die het licht absorberende molecuul chlorofie11 bevatten?  Welke chemische vergelijking toont het gele neerslag van ijzer?
Welke chemische vergelijking toont het gele neerslag van ijzer?  Wetenschappers gebruiken een teflonpijp om een goedkope, eenvoudige reactor voor de synthese van silicadeeltjes
Wetenschappers gebruiken een teflonpijp om een goedkope, eenvoudige reactor voor de synthese van silicadeeltjes Wat lost het beste op in water?
Wat lost het beste op in water?  Hoe een model van een calciumatom te bouwen
Hoe een model van een calciumatom te bouwen
 Nieuwe branden breken uit in Californië terwijl branden in wijnlanden doven
Nieuwe branden breken uit in Californië terwijl branden in wijnlanden doven Plastic afval:de nieuwe bedreiging voor koraalriffen wereldwijd
Plastic afval:de nieuwe bedreiging voor koraalriffen wereldwijd Fysiek, chemische en biologische effecten van smeltende ijskappen
Fysiek, chemische en biologische effecten van smeltende ijskappen De voordelen van bitter zijn:hoe de evolutie van de cranberry er een Thanksgiving-hoofdbestanddeel van maakte
De voordelen van bitter zijn:hoe de evolutie van de cranberry er een Thanksgiving-hoofdbestanddeel van maakte  Hoe het bestuderen van (robot)duivennavigatie mijn mening over hun intellect veranderde
Hoe het bestuderen van (robot)duivennavigatie mijn mening over hun intellect veranderde
Hoofdlijnen
- Wat is de wetenschappelijke betekenis van Justifyied?
- Is alles op één na een methode van passief transport in cellen?
- Is het Golgi -lichaam meestal bedekt met ribosomen?
- Verplaats fagocytose stoffen uit een cel?
- Microbieel moordmysterie opgelost
- Cultuur kan verklaren waarom hersenen groter zijn geworden
- Hoe bepaalt DNA de eigenschappen van een organisme?
- Hoe worden micro-organismen gebruikt in marmite?
- Wat is synaptische varicositeit die verwijst naar hoe veranderingen in sensibilisatie van Aplysia?
- Onderzoekers ontwikkelen 3D-geprinte vormgeheugenlegering met superieure superelasticiteit

- Ook na handen wassen, nieuwe vingerafdruktest kan onderscheid maken tussen personen die heroïne hebben gebruikt of gebruikt

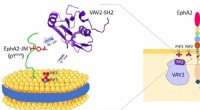
- Wetenschappers onthullen dubbele specificiteit van Vav2-SH2-eiwit
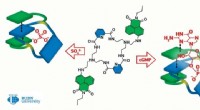
- Chemici maken een molecuul dat kan helpen bij de behandeling van hartaandoeningen en het opsporen van virussen
- Ontdekking kan leiden tot duurzame ethanol gemaakt van koolstofdioxide

 Klimaatbescherming:CO2 omgezet in methanol
Klimaatbescherming:CO2 omgezet in methanol Kun je de vulkanen in Pakistan noemen?
Kun je de vulkanen in Pakistan noemen?  Hoeveel zink zat er in het carbonaat?
Hoeveel zink zat er in het carbonaat?  Hoe kun je dierenpaden identificeren in sneeuw
Hoe kun je dierenpaden identificeren in sneeuw Hoe variantie te berekenen van een Ti84
Hoe variantie te berekenen van een Ti84  Vervuiling door nanopolitie
Vervuiling door nanopolitie Het hebben van een klok in je douche kan helpen om het waterverbruik te verminderen
Het hebben van een klok in je douche kan helpen om het waterverbruik te verminderen Hoe verhoudt de aarde zich in grootte tot de andere planeten?
Hoe verhoudt de aarde zich in grootte tot de andere planeten?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

