
Wetenschap
Wat zijn drie redenen waarom atomen binden?
1. Om een stabiele elektronenconfiguratie te bereiken: Atomen zijn het meest stabiel wanneer hun buitenste elektronenschil (valentieschaal) is gevuld. Door te binden met andere atomen, kunnen ze elektronen winnen, verliezen of delen om deze stabiele configuratie te bereiken, die lijken op de edelgassen. Dit wordt vaak de "octetregel" genoemd, waarbij atomen streven naar acht elektronen in hun valentieschaal.
2. om hun potentiële energie te verlagen: Binding geeft energie vrij, waardoor het resulterende molecuul stabieler en lagerer wordt in potentiële energie in vergelijking met de individuele, ongebonden atomen. Deze energie -release is de drijvende kracht achter de vorming van bindingen.
3. om een gunstiger evenwicht te bereiken van aantrekkelijke en afstotende krachten: Atomen bevatten zowel positief geladen kernen als negatief geladen elektronen. Wanneer atomen elkaar naderen, is er een evenwicht tussen aantrekkelijke krachten (tussen de kern van het ene atoom en de elektronen van het andere) en afstotende krachten (tussen de kernen van beide atomen en tussen de elektronen van beide atomen). Bonding treedt op wanneer de aantrekkelijke krachten opwegen tegen de afstotende krachten, wat leidt tot een netto aantrekkelijke interactie.
 Beschermend coatingmateriaal herstelt zichzelf in 30 minuten bij blootstelling aan zonlicht
Beschermend coatingmateriaal herstelt zichzelf in 30 minuten bij blootstelling aan zonlicht Wat is een voorbeeld van een solide diffusie?
Wat is een voorbeeld van een solide diffusie?  Hoe kan IR -spectroscopie worden gebruikt om cyclohaxanon aan te tonen, is omgezet in cyclohexanol?
Hoe kan IR -spectroscopie worden gebruikt om cyclohaxanon aan te tonen, is omgezet in cyclohexanol?  Baanbrekend onderzoek maakt kindervaccins veilig bij alle temperaturen
Baanbrekend onderzoek maakt kindervaccins veilig bij alle temperaturen Wetenschappers bedenken technologie om gebruikte kleding te recyclen in plaats van ze simpelweg te verbranden
Wetenschappers bedenken technologie om gebruikte kleding te recyclen in plaats van ze simpelweg te verbranden
 Ohio concentreert zich op het verminderen van schadelijke Lake Erie-algen
Ohio concentreert zich op het verminderen van schadelijke Lake Erie-algen De tropen breiden zich uit, en klimaatverandering is de belangrijkste boosdoener
De tropen breiden zich uit, en klimaatverandering is de belangrijkste boosdoener Op zoek naar water
Op zoek naar water Uitbarstende vulkaan op Spaans eiland blaast nieuwe spleet open
Uitbarstende vulkaan op Spaans eiland blaast nieuwe spleet open Onderzoekers onthullen hoe mycorrhiza-soorten de koolstof in de plantenbodem in bossen reguleren
Onderzoekers onthullen hoe mycorrhiza-soorten de koolstof in de plantenbodem in bossen reguleren
Hoofdlijnen
- Stappen van DNA-transcriptie
- Waarom wiebelen planten? Nieuw onderzoek biedt antwoorden
- Hoe menselijke transportgewoonten het gedrag van kleine mijten helpen verklaren
- Wat is de functie in waterlily vissen en parameciumcellen?
- Waarom is bioinformatica belangrijk in genetisch onderzoek?
- Wat zijn 4 kenmerken die alle soorten cellen gemeen hebben?
- Hoe je winnaar kunt worden in het evolutiespel
- Wat kan een glycoproteïne dat zich uitstrekt van het oppervlak van de cel?
- Wat betekent het woord dichtheid in de wetenschap?
- Onderzoek identificeert essentiële olieverbindingen die het meest giftig zijn voor bedwantsen

- Wetenschappers verkrijgen met succes een synthetische groeifactor die compatibel is met het inheemse eiwit
- Nieuw katalysatormateriaal produceert overvloedige goedkope waterstof

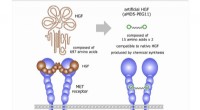
- Nieuwe familie in de buurt:een nieuwe groep glycosidische enzymen
- Infectie voorkomen met een verbeterde zilvercoating voor medische hulpmiddelen

 Oriëntatiepunten om donker te worden voor bewustzijn van uitsterven
Oriëntatiepunten om donker te worden voor bewustzijn van uitsterven Galactische crash heeft mogelijk de vorming van het zonnestelsel veroorzaakt
Galactische crash heeft mogelijk de vorming van het zonnestelsel veroorzaakt Zou een slechte millivolt-thermozuil ervoor zorgen dat de waakvlam in de vloeroven niet blijft branden?
Zou een slechte millivolt-thermozuil ervoor zorgen dat de waakvlam in de vloeroven niet blijft branden?  Grenzen doorbreken in kleine laboratoria:nieuwe technologie die gebruik maakt van geluidsgolven heeft implicaties voor de manipulatie van nanodeeltjes
Grenzen doorbreken in kleine laboratoria:nieuwe technologie die gebruik maakt van geluidsgolven heeft implicaties voor de manipulatie van nanodeeltjes  Wanneer verhoging verhoogt het zuurstofgehalte?
Wanneer verhoging verhoogt het zuurstofgehalte?  Welke dieren zullen de klimaatverandering overleven?
Welke dieren zullen de klimaatverandering overleven?  Menselijke activiteit maakt het voor wetenschappers moeilijker om oceanen uit het verleden te interpreteren
Menselijke activiteit maakt het voor wetenschappers moeilijker om oceanen uit het verleden te interpreteren  De tijd vliegen:ISU-professor onderzoekt hoe je het wachten met klanten kunt matigen
De tijd vliegen:ISU-professor onderzoekt hoe je het wachten met klanten kunt matigen
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

