
Wetenschap
Welke elektropicerende zilveren AG op Iron Fe Wat is geoxideerd?
Dit is waarom:
* Elektroplatingproces: Electroplating omvat het gebruik van een elektrische stroom om een dunne laag van een metaal (in dit geval zilver) op een substraat (in dit geval ijzer) af te zetten.
* oxidatie en reductie: Het proces omvat twee belangrijke reacties:oxidatie en reductie.
* oxidatie: Verlies van elektronen.
* reductie: Winst van elektronen.
* ijzer als de anode: Het ijzerobject is verbonden met de positieve terminal van de stroombron, waardoor het de anode is.
* zilver als de kathode: De zilverelektrode is verbonden met de negatieve terminal, waardoor deze de kathode is.
* IJzeroxidatie: Bij de anode (ijzer) verliezen ijzeratomen elektronen (oxidatie) en worden positief geladen ionen (Fe²⁺). Deze ionen lossen op in de elektrolytoplossing.
* zilverreductie: Bij de kathode (zilver) krijgen zilverionen (Ag⁺) van de elektrolytoplossing elektronen (reductie) en afzetting als vast zilver op het ijzeroppervlak.
Samenvattend: Het ijzer wordt geoxideerd omdat het elektronen verliest en ijzerionen vormt die oplossen in de oplossing. De zilverionen in de oplossing krijgen elektronen, worden vast zilver en plateren op het ijzerobject.
 Hoeveel elektronen kan de binnenste schil van een atoom bevatten?
Hoeveel elektronen kan de binnenste schil van een atoom bevatten?  Wetenschappers zetten bier om in brandstof
Wetenschappers zetten bier om in brandstof Wat is de naam gemeenschappelijke zuren aanwezig in oliën en vetten?
Wat is de naam gemeenschappelijke zuren aanwezig in oliën en vetten?  Een uitgebreide kijk op koemelk
Een uitgebreide kijk op koemelk Wetenschappers ontwikkelen stereogedefinieerde N- en S-atoom-gecodeerde graphdiyne voor zuurstofevolutie
Wetenschappers ontwikkelen stereogedefinieerde N- en S-atoom-gecodeerde graphdiyne voor zuurstofevolutie
Hoofdlijnen
- Wat zijn de verschillen van eenvoudig en gestratificeerd weefsel?
- Aanvallen of terugtrekken? Circuit verbindt honger en achtervolging in de hersenen van zeeslakken
- Wat is het verschil tussen een bioloog en wetenschapper?
- Hoe is het genoom als een open boek? Nieuw onderzoek toont het ‘bibliotheeksysteem’ van cellen aan
- Wat is de eerste barrière voor genenstroom in allopatrische speciatie?
- Wat 'Big Data' onthult over de diversiteit aan soorten
- Factoren die van invloed zijn op celverdeling
- Deeltjes surfen op hun eigen golven en laten zien hoe microben en cellen door het menselijk lichaam bewegen
- Wat bepaalt de samenstelling van microben in de darmen van een grasmus?
- Onderzoekers gebruiken zijde van zijderupsen om spierweefsel te modelleren

- Chemici bedenken nieuwe Lewis-zuurtest met behulp van fluorescentie

- Een technologie om 2D-vlakken om te zetten in zachte en flexibele 3D-structuren door hechting tussen dunne films te ontwikkelen

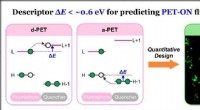
- Algemene descriptor zorgt voor vooruitgang in kleurstofchemie
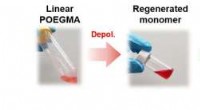
- Plastic afbreken in zijn samenstellende delen
 Wetenschappers identificeren potentiële bio-indicatoren voor het monitoren van plasticvervuiling in de noordelijke Stille Oceaan
Wetenschappers identificeren potentiële bio-indicatoren voor het monitoren van plasticvervuiling in de noordelijke Stille Oceaan Hoe komen de spermacellen in een stuifmeelkorrel aan bij de eicelklus in een plant-ovule?
Hoe komen de spermacellen in een stuifmeelkorrel aan bij de eicelklus in een plant-ovule?  Sterke versus zwakke zuren en basen
Sterke versus zwakke zuren en basen Welke van deze snelheid is sneller dan het zenuwspeed -elektriciteitssnelheidsgeluid of licht?
Welke van deze snelheid is sneller dan het zenuwspeed -elektriciteitssnelheidsgeluid of licht?  De studie van interactie tussen organismen en hun omgeving?
De studie van interactie tussen organismen en hun omgeving?  Natuurkundigen onderzoeken nieuwe klasse van resonatoren
Natuurkundigen onderzoeken nieuwe klasse van resonatoren Milieuvriendelijk textiel is gemakkelijk en goedkoop te vervaardigen
Milieuvriendelijk textiel is gemakkelijk en goedkoop te vervaardigen Een mediagigant op het spel:AT&T-antitrustproces gaat van start
Een mediagigant op het spel:AT&T-antitrustproces gaat van start
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

