
Wetenschap
Hoe was het testen van de elektrische geleidbaarheid van oplossing om het verschil tussen zout en suiker te vertellen?
* zout (NaCl): Zout is een ionische verbinding. Wanneer opgelost in water, dissocieert het in positief geladen natriumionen (Na+) en negatief geladen chloride-ionen (Cl-). Deze gratis ionen kunnen een elektrische stroom dragen, waardoor de oplossing geleidelijk wordt.
* Sugar (C12H22O11): Suiker is een covalente verbinding. Wanneer opgelost in water, breekt het niet af in ionen. In plaats daarvan vormt het suikermoleculen die neutraal zijn. Deze moleculen kunnen geen elektrische stroom dragen, waardoor de suikeroplossing niet-geleidend is.
Het experiment:
1. Materialen: U hebt een eenvoudig circuit nodig met een batterij, een gloeilamp en twee draden die op de lamp zijn aangesloten. Je hebt ook twee bekers, zout, suiker en gedestilleerd water nodig.
2. Procedure:
* Controle: Plaats de draden in het gedestilleerde water. De gloeilamp mag niet oplichten. Distilleerd water heeft zeer weinig ionen en is een slechte geleider.
* zout: Los wat zout op in water. Plaats de draden in de zoutoplossing. De gloeilamp moet oplichten. De ionen in de zoutoplossing dragen de stroom.
* Sugar: Los wat suiker op in water. Plaats de draden in de suikeroplossing. De gloeilamp mag niet oplichten. De suikeroplossing mist gratis ionen om de stroom te dragen.
Conclusie: Het vermogen van een oplossing om elektriciteit uit te voeren, is een betrouwbare indicator van of deze opgeloste ionen bevat. Zoutoplossingen leiden elektriciteit, terwijl suikeroplossingen niet doen.
 Wat gebeurt er als natrium en chloor worden gecombineerd?
Wat gebeurt er als natrium en chloor worden gecombineerd?  Waarom kunnen polaire moleculen niet overgaan tenzij?
Waarom kunnen polaire moleculen niet overgaan tenzij?  Hoeveel equivalente Lewis-structuren zijn nodig om de binding in SF2 te beschrijven?
Hoeveel equivalente Lewis-structuren zijn nodig om de binding in SF2 te beschrijven?  Welke term wordt gebruikt om de massa van 1 mol moleculen van een stof weer te geven?
Welke term wordt gebruikt om de massa van 1 mol moleculen van een stof weer te geven?  Hoe een glucoseoplossing te bereiden
Hoe een glucoseoplossing te bereiden
 Is er een groen ontwaken in China?
Is er een groen ontwaken in China? Is het isotone punt van zoutwaterplanten hoger dan zoet water?
Is het isotone punt van zoutwaterplanten hoger dan zoet water?  Modellering met hoge resolutie beoordeelt de impact van steden op rivierecosystemen
Modellering met hoge resolutie beoordeelt de impact van steden op rivierecosystemen Race is begonnen om het Great Salt Lake te redden:zal het genoeg zijn?
Race is begonnen om het Great Salt Lake te redden:zal het genoeg zijn? NASA-NOAA-satelliet ontdekt dat tropische storm Kiko in vorm blijft
NASA-NOAA-satelliet ontdekt dat tropische storm Kiko in vorm blijft
Hoofdlijnen
- Eerste structurele inzichten in hoe immuunreceptoren van planten op elkaar inwerken
- Is suiker zuur of onoplosbaar in water?
- Om de biosfeer voor toekomstige generaties te behouden, moeten mensen -?
- Waar vinden veel van de basislevensfuncties plaats in organismen?
- Wat zijn Gonads?
- Vijf olifanten gedood door trein in India
- Trucs voor het onthouden van dieren Phylum
- Een vroeg kerstcadeau:wetenschappers hebben het rendiergenoom uitgepakt
- Waarom communiceren wetenschappers de resultaten van hun onderzoek?
- Gouden microjuwelen uit de 3D-printer

- Nieuwe methode kan helpen onaangeboorde aardgasreservoirs te kwantificeren

- Chemici maken een sensor die nauwkeurig de speeksel-pH van mensen detecteert

- Microben kunnen de productie van geneesmiddelen efficiënter maken
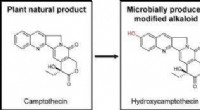
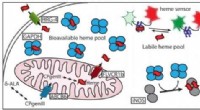
- Hoe cellen omgaan met een kleverige, giftig, maar absoluut essentieel molecuul
 Voer geen experimenten uit, tenzij je door je leraar wordt geïnstrueerd. Meng geen chemicaliën voor de lol?
Voer geen experimenten uit, tenzij je door je leraar wordt geïnstrueerd. Meng geen chemicaliën voor de lol?  Wat maakt iets wetenschappelijk?
Wat maakt iets wetenschappelijk?  Video:OPS-SAT, het vliegend laboratorium
Video:OPS-SAT, het vliegend laboratorium Chemie Nobel voor het gebruik van evolutie om nieuwe eiwitten te maken
Chemie Nobel voor het gebruik van evolutie om nieuwe eiwitten te maken Nieuwe slimme materialen om wereldwijde uitdagingen aan te gaan
Nieuwe slimme materialen om wereldwijde uitdagingen aan te gaan zuur is juist betekent rood?
zuur is juist betekent rood?  Hubble tuurt in een stoffige nevel van sterrenstelsels
Hubble tuurt in een stoffige nevel van sterrenstelsels Hoe dicht bij onzichtbaar kan een spiegel zijn?
Hoe dicht bij onzichtbaar kan een spiegel zijn?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

