
Wetenschap
Wat was Ernest Rutherford -model van het atoom?
Hier zijn de belangrijkste kenmerken van het model van Rutherford:
* Het atoom heeft een dichte, positief geladen kern in het midden: Deze kern bevat bijna alle massa van het atoom.
* elektronen rond de kern in cirkelvormige paden: Deze banen zijn niet vast en elektronen kunnen tussen verschillende energieniveaus springen.
* Het atoom is meestal lege ruimte: De kern is extreem klein in vergelijking met de totale grootte van het atoom, waardoor een enorme hoeveelheid lege ruimte tussen de kern en de elektronen achterblijft.
Hoe Rutherford bij dit model arriveerde:
Rutherford voerde zijn beroemde gouden folie -experiment uit, waarin hij een dun vel goudfolie bombardeerde met alfa -deeltjes (positief geladen deeltjes uitgestoten door radioactieve elementen). Hij observeerde het volgende:
* De meeste alfa -deeltjes passeerden dwars door de gouden folie: Dit gaf aan dat het atoom meestal lege ruimte is.
* Sommige alfa -deeltjes werden onder grote hoeken afgebogen: Dit suggereerde het bestaan van een klein, dicht, positief geladen gebied in het atoom, dat hij de kern noemde.
* Een paar alfa -deeltjes werden achteruit afgebogen: Dit was de meest verrassende observatie, omdat het impliceerde dat de kern extreem dicht was en zelfs de massieve alfa -deeltjes kon afbuigen.
Beperkingen van het model van Rutherford:
Hoewel het model van Rutherford een belangrijke doorbraak was, had het enkele beperkingen:
* Het kon de stabiliteit van atomen niet verklaren: Volgens het klassieke elektromagnetisme moeten elektronen die een kern draaien, energie verliezen en uiteindelijk in de kern spiraalden. Dit gebeurt echter niet.
* Het kon niet de verschillende spectrale lijnen verklaren waargenomen in atomaire emissies: Het model kon niet verklaren waarom atomen alleen licht uitzenden bij specifieke golflengten.
Latere ontwikkelingen:
De beperkingen van het model van Rutherford werden later aangepakt door Niels Bohr, die het Bohr -model in 1913 voorstelde. Het model van Bohr omvatte het concept van gekwantiseerde energieniveaus, wat de stabiliteit van atomen en de discrete spectrale lijnen verklaarde.
Samenvatting:
Het nucleaire model van Rutherford, hoewel later vervangen door meer verfijnde modellen, was een baanbrekende ontdekking die de basis legde voor ons begrip van atomaire structuur. Het vestigde het bestaan van de kern en bracht een revolutie teweeg in ons denken over het atoom, waardoor de weg werd vrijgemaakt voor verdere vooruitgang in atomaire fysica.
 De transformatie van een paar:hoe elektronen de stroom in 'slechte metalen' supertransporteren
De transformatie van een paar:hoe elektronen de stroom in 'slechte metalen' supertransporteren  Waarom reageert 1 zuurstofatoom met 2 waterstofatomen?
Waarom reageert 1 zuurstofatoom met 2 waterstofatomen?  Welk type chemische binding is c6h12o6?
Welk type chemische binding is c6h12o6?  Wat is een term voor vloeistof die dingen kan oplossen?
Wat is een term voor vloeistof die dingen kan oplossen?  Hoe verschilt een mengsel van waterstof en zuurstof van zuurstof?
Hoe verschilt een mengsel van waterstof en zuurstof van zuurstof?
 Reeks krachtige orkanen wakkert wetenschappelijk debat aan
Reeks krachtige orkanen wakkert wetenschappelijk debat aan Onderzoeker waarschuwt China's programma voor het meest risicovolle milieuproject in de geschiedenis
Onderzoeker waarschuwt China's programma voor het meest risicovolle milieuproject in de geschiedenis NASA legt de laatste buiging van Kai-Taks in tropische depressie vast
NASA legt de laatste buiging van Kai-Taks in tropische depressie vast De droom van een gasboom in Mozambique wordt bedreigd
De droom van een gasboom in Mozambique wordt bedreigd Evolutie na inslag van asteroïde Chicxulub:snelle reactie van leven op eind-krijtmassa
Evolutie na inslag van asteroïde Chicxulub:snelle reactie van leven op eind-krijtmassa
Hoofdlijnen
- Hoe bacteriën hyperefficiënte fotosynthesemachines bouwen
- Waarom zijn vervalbacteriën van levensbelang voor het leven op aarde?
- Hoe de ‘loopbandband’ zorgt voor een goede celdeling
- Wat voor soort weefsel is kalkoenvlees?
- Aangeboren gedrag bepaalt hoe we onze auto besturen
- Studie:hoe de hersenen uit delen een geheel maken
- Wat is slijmvliesverdikking in de ethmoid luchtcellen?
- Ontdekking van transcriptiefactor-eiwit dat koudetolerantie in rijst reguleert
- Hoe nieuw bewijs van geslachtsomkeringen laat zien hoe chromosomen in de loop van de evolutionaire tijd in stand worden gehouden
- Onderzoekers maken synthetische polymeren in levende cellen
- Wetenschappers maken polymeren om verboden stoffen in afvalwater op te sporen

- Eenvoudige vergelijking leidt tot het creëren van schone-energiekatalysatoren
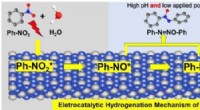
- Hydrogeneringsregeling van nitrobenzeen in elektrokatalytische processen gerealiseerd
- Bananenplantenextract kan de sleutel zijn tot romiger, langer houdbaar ijs

 Wat is de molariteit van een onbekend zuur als 40,5 ml kan worden getitreerd tot het eindpunt met 20,5.2250 M NaOH?
Wat is de molariteit van een onbekend zuur als 40,5 ml kan worden getitreerd tot het eindpunt met 20,5.2250 M NaOH?  Retailers kijken naar nieuwe technologie, gegevens om fortuinen te doen herleven
Retailers kijken naar nieuwe technologie, gegevens om fortuinen te doen herleven Krachtige tyfoon treft Filipijnen, minstens 10 doden (update)
Krachtige tyfoon treft Filipijnen, minstens 10 doden (update) Nieuwe strategie zou bestaande medicijnen in staat kunnen stellen bacteriën te doden die chronische infecties veroorzaken
Nieuwe strategie zou bestaande medicijnen in staat kunnen stellen bacteriën te doden die chronische infecties veroorzaken Is 26 pinten groter dan minder of gelijk aan 12 liter?
Is 26 pinten groter dan minder of gelijk aan 12 liter?  GPM-satelliet onderzocht tropische storm Chris-kracht
GPM-satelliet onderzocht tropische storm Chris-kracht Hoe u mijn klas gemiddeld kunt berekenen
Hoe u mijn klas gemiddeld kunt berekenen Kunstmatige intelligentie verbetert de controle over krachtige plasmaversnellers
Kunstmatige intelligentie verbetert de controle over krachtige plasmaversnellers
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

