
Wetenschap
Hoe weet je dat kalium een alkalimetaal zeer reactief?
1. Positie op het periodiek systeem:
* Alkali metaal: Kalium (k) woont in groep 1 van de periodiek systeem, de alkali metaalfamilie. Alleen al deze plaatsing vertelt ons dat het de karakteristieke eigenschappen van alkali -metalen bezit.
2. Elektronische configuratie:
* Eén valentie -elektron: Kalium heeft één elektron in zijn buitenste energieniveau (valentieschaal). Dit enkele elektron wordt losjes vastgehouden en gemakkelijk verloren, waardoor het zeer reactief is.
3. Chemische reacties:
* Krachtige reacties met water: Kalium reageert heftig met water en produceert waterstofgas en kaliumhydroxide. Deze reactie is zeer exotherme en genereert voldoende warmte om het waterstofgas te ontsteken.
* reacties met zuurstof: Kalium reageert gemakkelijk met zuurstof in de lucht en vormt kaliumoxide. Dit oxide reageert verder met vocht om kaliumhydroxide te creëren.
* reacties met halogenen: Kalium reageert krachtig met halogenen (zoals chloor) om ionische zouten te vormen (kaliumchloride).
4. Fysieke eigenschappen:
* zacht, zilverachtig metaal: Kalium is een zacht, zilverachtig wit metaal, dat een ander kenmerk is van alkali-metalen.
* Laag smelt- en kookpunten: In vergelijking met andere metalen heeft kalium een relatief laag smelt- en kookpunt. Dit weerspiegelt zijn zwakke metalen binding als gevolg van het losjes vastgehouden valentie -elektron.
Conclusie:
De combinatie van zijn positie op het periodiek systeem, elektronische configuratie en chemische reactiviteit met verschillende stoffen toont aan dat kalium een alkalimetaal is en inderdaad zeer reactief is.
Hoofdlijnen
- Wat als Homeostase mislukt?
- De verdeling van een celkern?
- Graslandmussen constant op zoek naar een mooier huis
- Wat is de collectieve set tools en applicaties die levende organismen hebben om producten te maken of te wijzigen?
- Wetenschappers ontdekken methode om voedselverspilling om te zetten in biobrandstoffen
- Botulisme bij watervogels:sterftecijfers en nieuwe inzichten in hoe het zich verspreidt
- Studie:Hoe we omgaan met dieren werpt licht op de Amerikaanse sociale ongelijkheid
- Zijn dubbelgangers echt? Er is een kans van 1 op een biljoen
- Is het Elkhorn Coral een Carnovore Omnivore of Herbivore?
- Nieuwe katalysator realiseert ongekende activiteiten

- Deze op RNA gebaseerde techniek zou gentherapie effectiever kunnen maken

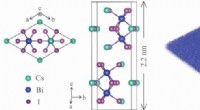
- De kansen zijn goed voor een unieke 2D-compound
- Strijd tegen antibioticaresistente bacteriën heeft een gloednieuw wapen
- Onderzoek geeft nieuw inzicht in de evolutie van het zenuwstelsel

 Kinderrace, geen arbeidsongeschiktheidsstatus, kan vaker opschorten voorspellen
Kinderrace, geen arbeidsongeschiktheidsstatus, kan vaker opschorten voorspellen Is er een celoppervlakmembraan op plantencel?
Is er een celoppervlakmembraan op plantencel?  Wetenschappers leren de olielens te beheersen
Wetenschappers leren de olielens te beheersen Wat gebeurt er met een regio wanneer radioactieve deeltjes worden vrijgegeven?
Wat gebeurt er met een regio wanneer radioactieve deeltjes worden vrijgegeven?  Onderzoekers ontwikkelen een nieuwe manier om een spectrum van natuurlijk ogende haarkleuren te creëren
Onderzoekers ontwikkelen een nieuwe manier om een spectrum van natuurlijk ogende haarkleuren te creëren Extreme blootstelling aan hitte verergert ondervoeding bij kinderen
Extreme blootstelling aan hitte verergert ondervoeding bij kinderen Beheersing van nanoclusters met oppervlaktedefecten kan leiden tot de constructie van nanodevices (met video)
Beheersing van nanoclusters met oppervlaktedefecten kan leiden tot de constructie van nanodevices (met video) Lipide nanodeeltjes-mRNA-regime keert ontstekingen om en bevordert het herstel van diabetische wonden bij muizen
Lipide nanodeeltjes-mRNA-regime keert ontstekingen om en bevordert het herstel van diabetische wonden bij muizen
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com


