
Wetenschap
Wat is de stip en kruis voor tetrachloormethaan?
Dit is waarom:
* ionische verbindingen betrokken zijn bij de overdracht van elektronen, wat leidt tot de vorming van ionen met tegengestelde ladingen. Het DOT- en Kruisdiagram vertegenwoordigt de overdracht van elektronen en de resulterende ladingen.
* Covalente verbindingen Betrek het delen van elektronen, niet de volledige overdracht. Dit delen resulteert in de vorming van covalente bindingen.
Om de binding in tetrachloormethaan weer te geven, zou u een Lewis -structuur gebruiken:
1. Centraal atoom: Koolstof (C) is het centrale atoom.
2. Valence -elektronen: Koolstof heeft 4 valentie -elektronen en elk chlooratoom heeft 7 valentie -elektronen.
3. binding: Carbon deelt één elektron met elk van de vier chlooratomen en vormt vier enkele covalente bindingen (C-CL).
4. eenzame paren: Elk chlooratoom heeft drie eenzame paren elektronen.
De Lewis -structuur voor tetrachloormethaan (CCL4) zou er zo uitzien:
Klet
|
Cl - C - Cl
|
Klet
Opmerking: De stippen vertegenwoordigen de valentie -elektronen van elk atoom en de lijnen vertegenwoordigen de gedeelde elektronenparen (covalente bindingen).
 Hoe te weten of een element een isotoop is?
Hoe te weten of een element een isotoop is?  Wanneer een vloeistof wordt verwarmd, wat gebeurt er met interdeeltjesruimtes?
Wanneer een vloeistof wordt verwarmd, wat gebeurt er met interdeeltjesruimtes?  Een virtueel substraat opent de weg naar oxidefilms op silicium voor toepassing in 5G, MEMS, sensoren en kwantumberekening
Een virtueel substraat opent de weg naar oxidefilms op silicium voor toepassing in 5G, MEMS, sensoren en kwantumberekening Snel gecontroleerd transport van waterdruppels door door zonlicht aangedreven pomp
Snel gecontroleerd transport van waterdruppels door door zonlicht aangedreven pomp Hoe wordt vast en gasvormig afval uitgescheiden bij mensen?
Hoe wordt vast en gasvormig afval uitgescheiden bij mensen?
 Onderzoekers tonen aan dat grotere plantengemeenschappen productiever zijn en gevoeliger voor klimaatopwarming
Onderzoekers tonen aan dat grotere plantengemeenschappen productiever zijn en gevoeliger voor klimaatopwarming  Hoe meer koolstof in de bodem op te slaan tijdens klimaatverandering
Hoe meer koolstof in de bodem op te slaan tijdens klimaatverandering  Wat was het doel van het naar Antarctica gaan?
Wat was het doel van het naar Antarctica gaan?  Seksuele voorlichting kan een tegenwicht bieden aan wat kinderen van porno leren, maar sommige leraren zijn bang voor terugslag als ze 'risicovolle' onderwerpen behandelen
Seksuele voorlichting kan een tegenwicht bieden aan wat kinderen van porno leren, maar sommige leraren zijn bang voor terugslag als ze 'risicovolle' onderwerpen behandelen  Vervuilingstabellen voor stedelijke gebieden in het VK onthullen het verwachte en onverwachte
Vervuilingstabellen voor stedelijke gebieden in het VK onthullen het verwachte en onverwachte
Hoofdlijnen
- Mysterieus bodemvirusgen voor het eerst gezien
- Waarom lachen mensen als ze gekieteld worden?
- Een nieuwe rol voor de eiwitfamilie zou een pad kunnen bieden voor de manier waarop gewaseigenschappen worden gewijzigd
- Wat zijn bycobacteriën?
- Wat maakt de dodelijke kogelvis zo verrukkelijk?
- Kunstmatige nesten zijn bedoeld om het broedsucces van de schuwe albatros te vergroten
- Team brengt in kaart hoe autofagie functioneert bij zoogdieren; SARS-CoV-2-infectie kan het proces verstoren
- Onderzoekers onthullen de evolutionaire oorsprong van eetlust door het eenvoudige zenuwstelsel van Hydra te bestuderen
- Gasachtige koeien zijn slecht voor de planeet; Kan een zeewierdieet helpen?
- Geen trial-and-error meer bij het kiezen van een elektrolyt voor metaal-luchtbatterijen
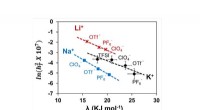
- Sneller giftige kankerverwekkende metalen vinden in voedsel en water

- Een kosteneffectieve methode om chemische bouwstenen te synthetiseren
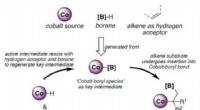
- Katalysator voor duurzame gassynthese
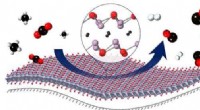
- Haar vindt nieuwe wortels als groeimedium voor stadslandbouw

 Hoe kunnen een spiercel en zenuw zo verschillend zijn als ze allebei exact dezelfde set chromosomen bevatten?
Hoe kunnen een spiercel en zenuw zo verschillend zijn als ze allebei exact dezelfde set chromosomen bevatten?  Hoe producten in chemische reacties te voorspellen
Hoe producten in chemische reacties te voorspellen Infraroodlasers onthullen ongekende details in oppervlakteverstrooiing van methaan
Infraroodlasers onthullen ongekende details in oppervlakteverstrooiing van methaan Hoe zeegezichten uit de oudheid de genetische structuur van Europese populaties hebben gevormd
Hoe zeegezichten uit de oudheid de genetische structuur van Europese populaties hebben gevormd Kan de oplosbaarheid worden verhoogd door roeren?
Kan de oplosbaarheid worden verhoogd door roeren?  Amazon investeert in Britse voedselkoerier Deliveroo
Amazon investeert in Britse voedselkoerier Deliveroo Bijna hele bevolking van Ecuador heeft online data gelekt
Bijna hele bevolking van Ecuador heeft online data gelekt Berichten van 's werelds kleinste ruimtesonde
Berichten van 's werelds kleinste ruimtesonde
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

