
Wetenschap
Wat zijn de voorbeelden van isotopen?
waterstof:
* protium (¹H): De meest voorkomende isotoop, met één proton en geen neutronen.
* deuterium (²H): Bevat één proton en één neutron. Het wordt gebruikt in nucleaire fusieonderzoek.
* tritium (³H): Bevat één proton en twee neutronen. Het is radioactief en gebruikt in sommige toepassingen zoals op tritium gebaseerde lichtbronnen.
koolstof:
* carbon-12 (¹²C): De meest voorkomende isotoop, met zes protonen en zes neutronen. Het vormt de basis van de atomaire massa -eenheid.
* carbon-14 (¹⁴C): Radioactief met zes protonen en acht neutronen. Gebruikt bij koolstofdatering om de leeftijd van oude artefacten te bepalen.
zuurstof:
* Oxygen-16 (¹⁶O): De meest voorkomende isotoop, met acht protonen en acht neutronen.
* Oxygen-18 (¹⁸O): Gebruikt in paleoklimaatonderzoek om temperaturen uit het verleden te bestuderen.
Uranium:
* uranium-235 (²³⁵u): Splijtbare isotoop gebruikt in kerncentrales en wapens.
* uranium-238 (²³⁸u): Meest voorkomende natuurlijke uraniumisotoop. Gebruikt in kerncentrales, maar niet splijtbaar.
Andere voorbeelden:
* kalium-40 (⁴⁰K): Radioactieve isotoop gevonden in bananen en gebruikt in dating van kaliumargon.
* chloor-35 (³⁵cl) en chloor-37 (³⁷cl): Beide komen van nature voor en dragen bij aan de gemiddelde chloormassa van chloor.
* Cobalt-60 (⁶⁰co): Radioactieve isotoop gebruikt bij medische radiotherapie.
* jodium-131 (¹³¹I): Radioactieve isotoop gebruikt in schildklierbehandelingen en medische beeldvorming.
Key Takeaways:
* isotopen van een element hebben hetzelfde aantal protonen maar verschillende aantallen neutronen. Dit leidt tot variaties in hun atoommassa.
* Sommige isotopen zijn radioactief , terwijl anderen stabiel zijn.
* isotopen hebben verschillende toepassingen in velden zoals geneeskunde, archeologie en energieproductie.
 Naar een nieuwe generatie vegetatiemodellen
Naar een nieuwe generatie vegetatiemodellen De manier waarop we water in ons lichaam transporteren, inspireert tot een nieuwe filtratiemethode
De manier waarop we water in ons lichaam transporteren, inspireert tot een nieuwe filtratiemethode  Enorme stormen treffen Noord-Europa, laat drie doden achter
Enorme stormen treffen Noord-Europa, laat drie doden achter Greenpeace slaat alarm over plasticvervuiling in rivieren
Greenpeace slaat alarm over plasticvervuiling in rivieren Mensen van kleur die meer worden blootgesteld aan hitte-eilanden, studie vondsten
Mensen van kleur die meer worden blootgesteld aan hitte-eilanden, studie vondsten
Hoofdlijnen
- Wat is het verschil tussen wetenschappelijke theorie en hypothese?
- Hoe is het meest voorkomende type lipide genoemd?
- Kun jij een paar haren van een renpaard stelen en je eigen haren klonen?
- Wat zijn de kleine haarachtige structuren langs je bodys slijmvliezen die pathogenen vangen en verwijderen?
- Geef een analogie die een situatie beschrijft waarin specifieke organismen of objecten een uniek rollensysteem hebben?
- Welke drie barrières kunnen populaties isoleren?
- De evolutie van slijm:hoe zijn we aan al dit slijm gekomen?
- Hoe worden chromosomen geanalyseerd binnen een karyotype?
- Waarom moeten er nog zoveel organismen worden ontdekt, geïdentificeerd en beschreven?
- Zelfs machines hebben hun groenten nodig

- Revolutionaire forensische vingerafdruktechniek kan helpen fraude te bestrijden

- Een nieuwe classificatie van symmetriegroepen in de kristalruimte voorgesteld door Russische wetenschappers
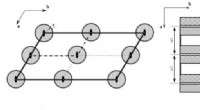
- Praktische oplossing voor het voorkomen van corrosieve opbouw in nucleaire systemen

- Metaalhydriden met verbeterde stabiliteit in water
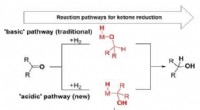
 Hoe E. coli veilig door maagzuur gaat
Hoe E. coli veilig door maagzuur gaat  Zijn waterjuffers in nood?
Zijn waterjuffers in nood?  Onderzoek naar de manier waarop planten suikers transporteren kan van cruciaal belang zijn in de opwarming van de aarde
Onderzoek naar de manier waarop planten suikers transporteren kan van cruciaal belang zijn in de opwarming van de aarde  Wat zit er achter het geloof in een soulmate?
Wat zit er achter het geloof in een soulmate? Welke andere functie heeft een plantencel een dier?
Welke andere functie heeft een plantencel een dier?  NASA-infraroodgegevens richten zich op Maria's sterkste kant
NASA-infraroodgegevens richten zich op Maria's sterkste kant Met koolstof nanobuisjes, een weg naar flexibele, goedkope sensoren
Met koolstof nanobuisjes, een weg naar flexibele, goedkope sensoren Nieuwe techniek geeft vijvers op Arctisch zee-ijs nauwkeuriger weer
Nieuwe techniek geeft vijvers op Arctisch zee-ijs nauwkeuriger weer
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

