
Wetenschap
Waarom hebben geen vloeistoffen noch gassen vaste vormen?
vloeistoffen:
* Zwakke intermoleculaire krachten: De moleculen in vloeistoffen worden bij elkaar gehouden door zwakkere krachten in vergelijking met vaste stoffen. Deze krachten zijn sterk genoeg om de moleculen dicht bij elkaar te houden, maar niet sterk genoeg om ze in een vaste opstelling te houden.
* vloeibare aard: Vloeistoffen worden als vloeistof beschouwd omdat hun moleculen gemakkelijk langs elkaar kunnen glijden. Hierdoor kunnen ze stromen en de vorm van hun container aannemen.
gassen:
* Zeer zwakke intermoleculaire krachten: De moleculen in gassen hebben extreem zwakke intermoleculaire krachten. Ze bewegen zich vrij en onafhankelijk, met heel weinig aantrekkingskracht op elkaar.
* Hoge kinetische energie: Gasmoleculen hebben een hoge kinetische energie, wat betekent dat ze constant bewegen en tegen elkaar botsen. Deze constante beweging voorkomt dat ze een vaste vorm vormen.
Samenvattend:
Het ontbreken van een vaste vorm in vloeistoffen en gassen is te wijten aan de combinatie van zwakkere intermoleculaire krachten en het vermogen van hun moleculen om vrij ten opzichte van elkaar te bewegen. Hierdoor kunnen ze de vorm van hun container aannemen.
 Onderzoekers verkrijgen nieuwe resultaten over diëlektrische recombinatie-precisiespectroscopie
Onderzoekers verkrijgen nieuwe resultaten over diëlektrische recombinatie-precisiespectroscopie Wat zijn droogbaar stof en wat de componenten?
Wat zijn droogbaar stof en wat de componenten?  Waar is methaan een belangrijk onderdeel van?
Waar is methaan een belangrijk onderdeel van?  Wat is acromegly?
Wat is acromegly?  In reclamespots voor maagzuurremmers wordt vaak beweerd dat deze producten maagzuur neutraliseren. Antacida zijn basen. Wat zou een analogie zijn van de manier waarop zuren?
In reclamespots voor maagzuurremmers wordt vaak beweerd dat deze producten maagzuur neutraliseren. Antacida zijn basen. Wat zou een analogie zijn van de manier waarop zuren?
Hoofdlijnen
- Welke positieve effecten hebben mensen op inktvis?
- Wat is het ontginnen van hypothesen?
- Welke kernen zou het minst stabiel zijn?
- Natuurbeschermingsgroep zegt dat Japan helpt bij illegale ivoorhandel (update)
- Wat is waar aan alle verschillende soorten wetenschappers?
- Commensalisme: definitie, types, feiten en voorbeelden
- Leg uit hoe de genetische code zowel continuïteit als verandering toont?
- Waarom was Charles Darwin zo'n belangrijke wetenschapper?
- Waarom wordt de evolutietheorie weerlegd dat God uw Schepper is?
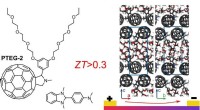
- Warmte omzetten in kracht met efficiënt organisch thermo-elektrisch materiaal
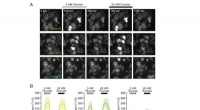
- Op groene fluorescerende eiwitten gebaseerde glucose-indicatoren voor realtime monitoring van het glucosemetabolisme
- Wetenschappers melden een nieuwe cascadereactie

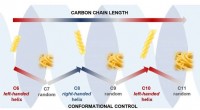
- Koolstofketens nemen fusilli- of spaghetti-vormen aan als ze oneven of even getallen hebben
- Antibacteriële sportkleding? De claim is net zo absurd als het klinkt

 Wave-apparaat kan duizenden huizen van schone energie voorzien
Wave-apparaat kan duizenden huizen van schone energie voorzien Inches converteren naar Mm
Inches converteren naar Mm Is het waar dat de wereld zal sterven in 1012 van een zonsverduistering?
Is het waar dat de wereld zal sterven in 1012 van een zonsverduistering?  Berichten over het overlijden van Jupiters Grote Rode Vlek sterk overdreven
Berichten over het overlijden van Jupiters Grote Rode Vlek sterk overdreven Hoe zijn lezen en schrijven ontstaan? Neurowetenschap geeft een idee
Hoe zijn lezen en schrijven ontstaan? Neurowetenschap geeft een idee Wat is jaloezie? Hoe verschilt jaloezie van afgunst?
Wat is jaloezie? Hoe verschilt jaloezie van afgunst?  Wetenschappers creëren een super-antioxidant:gemeenschappelijke katalysator ceriumoxide opent de deur naar nanochemie voor medicijnen
Wetenschappers creëren een super-antioxidant:gemeenschappelijke katalysator ceriumoxide opent de deur naar nanochemie voor medicijnen Omkeerbare montage leidt tot kleine versleutelde berichten
Omkeerbare montage leidt tot kleine versleutelde berichten
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

