
Wetenschap
Wanneer verliest een atoom elektronen door ionische binding?
* ionische binding: Een ionische binding ontstaat wanneer het ene atoom (het metaal) elektronen verliest en positief wordt geladen (kation), terwijl het andere atoom (het niet -metalen) die elektronen wint en negatief wordt geladen (anion). De tegenovergestelde ladingen trekken elkaar vervolgens aan, waardoor de binding ontstaat.
* ionisatie -energie: Ionisatie -energie is de energie die nodig is om een elektron uit een neutraal atoom in zijn gasvormige toestand te verwijderen. Atomen met lage ionisatie -energieën hebben meer kans om elektronen te verliezen omdat er minder energie voor nodig is.
Hier is hoe het in meer detail werkt:
1. metalen: Metalen hebben meestal lage ionisatie -energieën. Dit betekent dat het gemakkelijker is om elektronen ervan te verwijderen.
2. Niet -metalen: Niet -metalen hebben hogere ionisatie -energieën, wat betekent dat er meer energie nodig is om elektronen te verwijderen.
3. Elektronenoverdracht: Wanneer een metaal en een niet -metaal samenkomen, verliest het metaalatoom gemakkelijk een elektron (of elektronen) om een kation te worden, en het niet -metalen atoom laat die elektronen een anion worden.
4. Elektrostatische aantrekkingskracht: De tegengesteld geladen ionen worden vervolgens tot elkaar aangetrokken door elektrostatische krachten, waardoor de ionische binding wordt gevormd.
Voorbeeld:
Overweeg de vorming van natriumchloride (NaCl):
* natrium (na) is een metaal met een lage ionisatie -energie. Het verliest gemakkelijk één elektron om een natriumion te worden (Na+).
* chloor (Cl) is een niet -metaal met een hogere ionisatie -energie. Het krijgt het door natrium verloren elektron om een chloride-ion te worden (Cl-).
* De Na+ en Cl-ionen trekken elkaar vervolgens aan en vormen de ionische verbinding NaCl.
Samenvattend: Atomen met lage ionisatie -energieën verliezen eerder elektronen en vormen ionische bindingen met atomen die een hoge elektronegativiteit hebben.
 Onze wereld is rijk aan plaatsen om echte dinosaurussporen te zien
Onze wereld is rijk aan plaatsen om echte dinosaurussporen te zien  Het verschil tussen harde en zachte tarwe
Het verschil tussen harde en zachte tarwe  Affakkelen zorgt ervoor dat er meer methaan in de atmosfeer komt dan we dachten
Affakkelen zorgt ervoor dat er meer methaan in de atmosfeer komt dan we dachten Studie bevestigt dat de Oost-Antarctische ijskap stabiel blijft, zelfs als de westelijke ijskap smelt
Studie bevestigt dat de Oost-Antarctische ijskap stabiel blijft, zelfs als de westelijke ijskap smelt Zwarte zomerbranden in Australië hebben de ozonlaag aangetast:studie
Zwarte zomerbranden in Australië hebben de ozonlaag aangetast:studie
Hoofdlijnen
- Welke van de volgende technologieën opende een nieuwe takwetenschap in de jaren 1970 A. Lichtmicroscoop B. Veranderende genen Bacteriën C. Centrifuge D. Chromatografie?
- Zijn kwallenleden van de cnidarian -klasse?
- Waarom is de landbouw geëvolueerd?
- Wat zijn de kleine segmenten van DNA die de vorming van eiwitten regelen?
- Welke plantencel absorbeert water uit de grond?
- Wat is de oorsprong van bot?
- Hoe wordt een meniscus gebruikt bij het meten?
- Zijn wetenschappers alle variabelen constant waar of onwaar?
- Wat zijn de verschillen van eenvoudig en gestratificeerd weefsel?
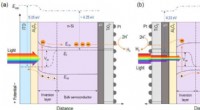
- Ruimtelijke ontkoppeling van lichtabsorptie- en reactieplaatsen in n-Si-fotokathoden voor het splitsen van zonnewater
- Mac en kaas naar Mars brengen

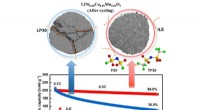
- Nieuwe combinatie van materialen zorgt voor recordbrekende lithium-metaalcel
- Coating voor metalen geneest snel over krassen en schaafwonden om corrosie te voorkomen

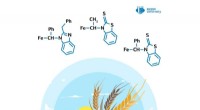
- Chemicus maakt stoffen die de plantengroei stimuleren
 Hoeveel mensen op Pearys Expedition bereikten de Noordpool?
Hoeveel mensen op Pearys Expedition bereikten de Noordpool?  Wat zal het volume zijn van 16,0 gram zwaveldioxidegas bij 35 C en 97 ATM?
Wat zal het volume zijn van 16,0 gram zwaveldioxidegas bij 35 C en 97 ATM?  Hoe biologische afbraakadditieven werken
Hoe biologische afbraakadditieven werken  Zijn gasboilers goedkoper om te gebruiken dan elektrische kachels?
Zijn gasboilers goedkoper om te gebruiken dan elektrische kachels?  Biovriendelijke protocellen pompen bloedvaten op
Biovriendelijke protocellen pompen bloedvaten op Kunnen metalen hun vorm op nanoschaal onthouden, te?
Kunnen metalen hun vorm op nanoschaal onthouden, te? Veilig type:consumenten zeggen dat compacte logo's de veiligheid van producten aangeven
Veilig type:consumenten zeggen dat compacte logo's de veiligheid van producten aangeven Klimaatverandering:het leven van Naur in de frontlinie
Klimaatverandering:het leven van Naur in de frontlinie
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

