
Wetenschap
Waarom fenobarbital oplosbaar in organisch oplosmiddel meer dan waterig oplosmiddel?
* Fenobarbital structuur: Fenobarbital heeft een structuur gedomineerd door een niet -polair ringsysteem en een carbonylgroep (C =O). Hoewel de carbonylgroep enige polariteit heeft, is het minder polair dan de rest van het molecuul.
* Oplosbaarheidsprincipe: "Zoals oplost zoals." Dit betekent dat stoffen met vergelijkbare polariteit de neiging hebben om goed te mengen.
* Organische oplosmiddelen: Organische oplosmiddelen zijn over het algemeen niet -polair (bijv. Diethylether, chloroform, tolueen). Door het niet -polaire karakter van Fenobarbital kan het gunstig communiceren met de niet -polaire moleculen van deze oplosmiddelen, wat leidt tot een grotere oplosbaarheid.
* waterige oplosmiddelen: Water is een zeer polair oplosmiddel. De beperkte polariteit van Fenobarbital maakt het moeilijk om sterke interacties te vormen met watermoleculen. Het resultaat is een lagere oplosbaarheid in water.
Samenvattend:
* Fenobarbital's niet -polaire karakter is de belangrijkste reden voor zijn betere oplosbaarheid in niet -polaire organische oplosmiddelen in vergelijking met polaire waterige oplosmiddelen.
* Het "Like Lost Like" -principe regelt dit gedrag, wat de voorkeur geeft aan interacties tussen moleculen met vergelijkbare polariteiten.
 Door te luisteren leren wetenschappers hoe een eiwit vouwt
Door te luisteren leren wetenschappers hoe een eiwit vouwt  Wat is een juiste beschrijving van enthalpie -reactie?
Wat is een juiste beschrijving van enthalpie -reactie?  Wat maken waterstofzwavel en zuurstof?
Wat maken waterstofzwavel en zuurstof?  Is het plaatsen van ijs in een chemische of fysieke verandering in een drankje?
Is het plaatsen van ijs in een chemische of fysieke verandering in een drankje?  Kruiskoppelingsreacties:semiheterogene op PCN-Cu gebaseerde metallafotokatalyse
Kruiskoppelingsreacties:semiheterogene op PCN-Cu gebaseerde metallafotokatalyse
 Een staartje krijgen op natuurbehoud?
Een staartje krijgen op natuurbehoud?  Als de verwarming aan is, we hebben stadsbrede plannen nodig om koel te blijven
Als de verwarming aan is, we hebben stadsbrede plannen nodig om koel te blijven Duizenden bestrijden bosbranden die Californische sequoia's bedreigen
Duizenden bestrijden bosbranden die Californische sequoia's bedreigen Wat is de wetenschappelijke naam of taxonomische classificatie van Giftous Plant Gemmed Amanita?
Wat is de wetenschappelijke naam of taxonomische classificatie van Giftous Plant Gemmed Amanita?  Het einde van de ontbossing in het Braziliaanse Amazonegebied?
Het einde van de ontbossing in het Braziliaanse Amazonegebied?
Hoofdlijnen
- Op het spoor van de mondiale klimaatverandering – vulkanisme als aanjager van het klimaat tijdens de Carnische Crisis
- Wat is vergelijkbaar met een vet en gevonden in celmembranen?
- Waarom gebruiken wetenschappers modellen?
- Wat is de definitie van hersenstam en cerebellum?
- Leg uit hoe het zenuwstelsel samenwerkt met andere systemen in het lichaam?
- Onderzoek naar hoe genen activeren levert verrassende ontdekkingen op
- Hoe noem je een kiem -expert?
- Stappen voor het succesvol telen van zoete aardappelen in Washington
- Wat is de regeling in de microbiologie?
- Lichtgevoelig molecuul helpt zeedieren hun voortplantingscyclus te synchroniseren
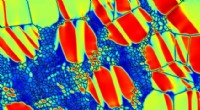
- Metaal leidt tot de gewenste configuratie

- In legeringen met vormgeheugen, de juiste combinatie van kristalkorrels kan een hoge sterkte bereiken en toch geheugen behouden
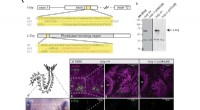
- Versleutelde, one-touch, mens-machine-interfacetechnologie onthult gebruikersfysiologie

- Verbetering van de prestaties van een thermo-elektrisch materiaal door selectieve atomen gedeeltelijk te vervangen door kationen

 Amazone-vlinders laten zien hoe nieuwe soorten kunnen evolueren uit hybridisatie
Amazone-vlinders laten zien hoe nieuwe soorten kunnen evolueren uit hybridisatie  Onderzoekers hebben met succes ultrafijne nanostaafjes van NiS gefabriceerd met gescheiden symmetrie langs twee richtingen
Onderzoekers hebben met succes ultrafijne nanostaafjes van NiS gefabriceerd met gescheiden symmetrie langs twee richtingen  Aangezien glas niet erg flexibel is, kan het uiteenvallen als een zanger een noot produceert met dezelfde natuurlijke frequentie als wat voor soort golfinteractie is dit voorbeeld?
Aangezien glas niet erg flexibel is, kan het uiteenvallen als een zanger een noot produceert met dezelfde natuurlijke frequentie als wat voor soort golfinteractie is dit voorbeeld?  Wat veroorzaakt ionische wind?
Wat veroorzaakt ionische wind?  Wat is het oxidatiegetal van titanium?
Wat is het oxidatiegetal van titanium?  Wat is een dunne strook land, meestal omringd door water?
Wat is een dunne strook land, meestal omringd door water?  Klimaatverandering verandert de winterneerslag op het noordelijk halfrond
Klimaatverandering verandert de winterneerslag op het noordelijk halfrond Heeft magnesiumnitride een ionische of covalente binding?
Heeft magnesiumnitride een ionische of covalente binding?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

