
Wetenschap
Waarom worden organische oplosmiddelen niet -polair oplosmiddel genoemd?
Waarom veel organische oplosmiddelen niet -polair zijn:
* Structuur: Organische moleculen zijn in het algemeen samengesteld uit koolstof en waterstof, die vergelijkbare elektronegativiteit hebben. Dit betekent dat de elektronen relatief gelijk worden gedeeld tussen hen, wat leidt tot een evenwichtige ladingsverdeling en een niet -polair molecuul.
* intermoleculaire krachten: Niet -polaire moleculen vertonen voornamelijk zwakke dispersiekrachten in Londen (LDF's), die voortkomen uit tijdelijke schommelingen in elektronenverdeling. Deze krachten zijn zwakker dan de dipool-dipoolinteracties of waterstofbinding gevonden in polaire moleculen.
Voorbeelden van niet -polaire organische oplosmiddelen:
* hexane
* Diethylether
* tolueen
* benzeen
* chloroform
Polaire organische oplosmiddelen:
Er zijn ook verschillende organische oplosmiddelen die polariteit vertonen:
* methanol
* ethanol
* aceton
* Dimethylsulfoxide (DMSO)
* tetrahydrofuran (thf)
Deze moleculen bevatten functionele groepen zoals hydroxyl (-OH), carbonyl (C =O) of ether (C-O-C) die een significant verschil in elektronegativiteit introduceren, wat leidt tot een dipoolmoment en het maken van het molecuul polair.
Key Takeaway:
Hoewel veel organische oplosmiddelen niet -polair zijn vanwege hun moleculaire structuur en zwakke intermoleculaire krachten, is het cruciaal om te onthouden dat sommige organische oplosmiddelen polair zijn. Raadpleeg altijd naar de specifieke eigenschappen van een oplosmiddel voordat u het in een toepassing gebruikt.
 Welke vorm heeft het molecuul SiF4?
Welke vorm heeft het molecuul SiF4?  Waarom zijn ionische reacties niet omkeerbaar?
Waarom zijn ionische reacties niet omkeerbaar?  Wetenschappers vinden een manier om pultrusie sneller te laten verlopen
Wetenschappers vinden een manier om pultrusie sneller te laten verlopen IVF-boost:akoestische golven gebruiken om sperma van hoge kwaliteit te selecteren
IVF-boost:akoestische golven gebruiken om sperma van hoge kwaliteit te selecteren Waarom zijn reactievolgordes niet altijd gelijk aan de coëfficiënten in een chemische vergelijking?
Waarom zijn reactievolgordes niet altijd gelijk aan de coëfficiënten in een chemische vergelijking?
Hoofdlijnen
- Wat is de functie van enzymen in biologische reactie?
- Kun je leven zonder zuurstof? Dit dier kan
- Hoe heet een jonge plant die in zaad groeit?
- Hoe ziekteverwekkers mitochondriale afweermechanismen kunnen uitschakelen
- Wat is het proces dat genetische diversiteit in populaties mogelijk maakt, is?
- Hoe grassen zoals tarwe in de kou kunnen groeien
- Kunnen ziektetolerantiegenen nieuw leven geven aan Britse essen?
- Wat hebben eukaryoten en prokaryoten?
- Studie onderzoekt welke micro-organismen op Mars nodig zouden hebben om te overleven
- Onderzoek naar oppervlaktespanning zeewater wordt internationale richtlijn

- Een 4 V-klasse metaalvrije organische lithium-ionbatterij komt dichter bij de realiteit
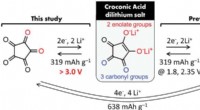
- Wetenschappers ontdekken belangrijke oorzaak van resistentie in vaste elektrolyten

- Copycat-cellen beschikken over nieuwe communicatiekrachten

- Hoe duidelijker rapportage van negatieve experimentele resultaten de reactieplanning in de chemie zou verbeteren
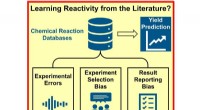
 Bacteriën worden niet gebruikt om te maken?
Bacteriën worden niet gebruikt om te maken?  Onderzoeker bespreekt stalking in het tijdperk van sociale media
Onderzoeker bespreekt stalking in het tijdperk van sociale media Hoe pittig wordt mosterd afhankelijk van de grondsoort?
Hoe pittig wordt mosterd afhankelijk van de grondsoort?  Welk element heeft een atoomnummer dat het dubbele is van dat van siliconen?
Welk element heeft een atoomnummer dat het dubbele is van dat van siliconen?  Nieuw onderzoek laat zien hoe verstoring van de tarwehandel de voedselzekerheid kan beïnvloeden
Nieuw onderzoek laat zien hoe verstoring van de tarwehandel de voedselzekerheid kan beïnvloeden  Hoe fungeren de mitochondriën als keuken van cel?
Hoe fungeren de mitochondriën als keuken van cel?  Kunnen telescopen Mars in detail zien?
Kunnen telescopen Mars in detail zien?  Nanomateriaal is ionen te slim af
Nanomateriaal is ionen te slim af
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

