
Wetenschap
Wat zou het verschil in grootte van kristallen zijn tussen een zoutoplossing die is verdampt door te verwarmen met bunsenbrander en er één werd overgelaten om de normale kamertemperatuur te verdampen?
* Verdampingssnelheid: Het verwarmen van de oplossing met een bunsenbrander veroorzaakt veel snellere verdamping. De watermoleculen verlaten de oplossing snel, waardoor een geconcentreerde zoutoplossing achterblijft. Deze snelle concentratieverandering laat minder tijd voor de zoutionen om zich in grote, goed gevormde kristallen te regelen.
* nucleatie -sites: Met snellere verdamping vormen meer nucleatieplaatsen (punten waar kristalgroei begint) in de oplossing. Dit leidt tot de vorming van een groter aantal kleinere kristallen in plaats van een paar grote.
Verdamping van kamertemperatuur:
* langzame verdamping: Bij kamertemperatuur is het verdampingsproces veel langzamer. Dit geeft de zoutionen voldoende tijd om te bewegen en elkaar te vinden, waardoor grotere en meer goed gedefinieerde kristallen worden gevormd.
* Minder nucleatie -sites: Langzamere verdamping leidt tot minder nucleatieplaatsen, waardoor grotere kristallen kunnen groeien.
Samenvattend: Snellere verdamping van verwarming leidt tot kleinere kristallen, terwijl langzamere verdamping bij kamertemperatuur een grotere kristalvorming mogelijk maakt.
 Hydrogel regelt de celgroei buiten het lichaam
Hydrogel regelt de celgroei buiten het lichaam Als we begrijpen hoe katalysatoren verouderen, kan het industriële gebruik worden geoptimaliseerd
Als we begrijpen hoe katalysatoren verouderen, kan het industriële gebruik worden geoptimaliseerd  Onderzoekers creëren aerogels met vormgeheugen met rubberachtige elasticiteit
Onderzoekers creëren aerogels met vormgeheugen met rubberachtige elasticiteit Geen laboratorium nodig:nieuwe technologie kan infecties binnen enkele minuten diagnosticeren
Geen laboratorium nodig:nieuwe technologie kan infecties binnen enkele minuten diagnosticeren Is O2 een voorbeeld van een polaire covalente binding of een niet-polaire binding?
Is O2 een voorbeeld van een polaire covalente binding of een niet-polaire binding?
 Wat is een zaadlaag?
Wat is een zaadlaag?  Onderzoek bevestigt fecale bacteriën vervuild oppervlaktewater na orkaan Harvey
Onderzoek bevestigt fecale bacteriën vervuild oppervlaktewater na orkaan Harvey Klimaatverandering vraagt om een frisse benadering van waterproblemen
Klimaatverandering vraagt om een frisse benadering van waterproblemen Bestaat de mannelijkheid alleen uit fysiek uiterlijk?
Bestaat de mannelijkheid alleen uit fysiek uiterlijk?  Ruimteradar suggereert Noord-Koreaanse kernbom gelijk aan 17 Hiroshimas
Ruimteradar suggereert Noord-Koreaanse kernbom gelijk aan 17 Hiroshimas
Hoofdlijnen
- Biochemici gaan onderzoeken hoe gewassen de eiwitproductie kunnen verhogen
- Wat hoorden dinosaurussen?
- Hoe onderzoekers naar het vogelbrein in actie kijken
- Waarom zouden wetenschappers communiceren met andere wetenschappers?
- Wat zijn de verschillende soorten microscopen en wie heeft het uitgevonden?
- Wat zijn proteomische hulpmiddelen en hun toepassingen?
- Kombucha:Wat het is, waar komt het vandaan
- Waarom verzamelen vrouwelijke grote hamerhaaien zich elke zomer in Frans-Polynesië?
- Hoe een eiwitcomponent van nucleaire poriecomplexen de ontwikkeling van bloedcellen reguleert, draagt bij aan myeloïde aandoeningen
- Het onvermengbare mengen:een nieuwe benadering voor het efficiënt samensmelten van verschillende polymeren
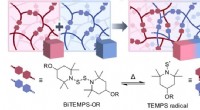
- Onderzoekers creëren smartphonesysteem om te testen op lood in water

- Een efficiëntere op membraan gebaseerde generator voor het oogsten van osmotisch vermogen (update)
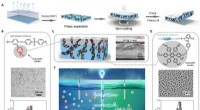
- Geïntegreerde waterstofopslag voor brandstofcelauto's

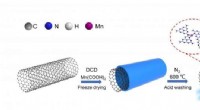
- Mangaan single-atom katalysator verhoogt de prestaties van elektrochemische kooldioxide-reductie
 Hoe een eenvoudige wiskundige formule de bizarre prevalentie van altruïsme in de samenleving begint te verklaren
Hoe een eenvoudige wiskundige formule de bizarre prevalentie van altruïsme in de samenleving begint te verklaren  Een rechthoek is 25 voet lang het gebied 375 vierkant wat de omtrek?
Een rechthoek is 25 voet lang het gebied 375 vierkant wat de omtrek?  Grote nieuwe studie toont oude internationale handelsroutes tussen Exeter en Europa
Grote nieuwe studie toont oude internationale handelsroutes tussen Exeter en Europa Game of Thrones-prequel bevestigt dat er geen seksueel geweld op het scherm zal zijn. Dit is waarom dat belangrijk is
Game of Thrones-prequel bevestigt dat er geen seksueel geweld op het scherm zal zijn. Dit is waarom dat belangrijk is Hoe ernstig zijn die softwarefouten?
Hoe ernstig zijn die softwarefouten? Bindingsmechanisme met eenmaal korting kan de sleutel zijn om virussen te targeten
Bindingsmechanisme met eenmaal korting kan de sleutel zijn om virussen te targeten Onderzoek toont aan dat veelgebruikte methoden voor machinaal leren niet werken zoals wordt beweerd
Onderzoek toont aan dat veelgebruikte methoden voor machinaal leren niet werken zoals wordt beweerd Lineaire dichtheid berekenen
Lineaire dichtheid berekenen
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

