
Wetenschap
Wat gebeurt er als zuurstof zich hecht aan organische moleculen?
soorten oxidatie:
* toevoeging: Zuurstofatomen worden rechtstreeks aan het molecuul toegevoegd, waardoor het zuurstofgehalte wordt vergroot.
* Voorbeeld:de conversie van een alkaan naar een alcohol.
* vervanging: Zuurstofatomen vervangen andere atomen in het molecuul.
* Voorbeeld:de oxidatie van een aldehyde tot een carbonzuur.
* splitsing: Het molecuul wordt opgesplitst in kleinere moleculen, vaak met de toevoeging van zuurstof.
* Voorbeeld:de oxidatie van een glucosemolecuul tijdens cellulaire ademhaling.
Effecten van oxidatie:
* Energie -release: Oxidatie van organische moleculen brengt energie vrij, die vaak wordt benut door levende organismen om hun metabole processen te voeden. Dit is de basis van ademhaling en verbranding.
* Vorming van nieuwe functionele groepen: Oxidatie kan nieuwe functionele groepen (zoals hydroxylgroepen, carbonylgroepen of carbonzuurgroepen) introduceren in organische moleculen, waardoor hun chemische eigenschappen en reactiviteit veranderen.
* Veranderingen in fysieke eigenschappen: Oxidatie kan het smeltpunt, het kookpunt, de oplosbaarheid en andere fysische eigenschappen van het molecuul veranderen.
* Afbraak: In sommige gevallen kan oxidatie complexe moleculen afbreken in eenvoudigere. Dit proces is essentieel voor afvalverwijdering en recycling binnen levende organismen.
Voorbeelden in de biologie:
* Cellulaire ademhaling: Glucose wordt geoxideerd tot koolstofdioxide en water, waardoor energie wordt vrijgelaten die onze cellen aandrijft.
* fotosynthese: Kooldioxide wordt verminderd (het tegenovergestelde van oxidatie) tegen glucose, met behulp van energie uit zonlicht.
* Lipidemetabolisme: Vetten worden afgebroken door oxidatie om energie te genereren.
* Antioxidant -verdediging: Antioxidanten zoals vitamine C en E beschermen cellen tegen schade veroorzaakt door vrije radicalen, zeer reactieve zuurstofmoleculen die cellulaire schade kunnen veroorzaken.
Voorbeelden in de industrie:
* verbranding: Brandende brandstoffen zoals hout en olie omvat de snelle oxidatie van de moleculen, waardoor warmte en licht worden vrijgelaten.
* chemische synthese: Oxidatie wordt gebruikt om een breed scala aan industriële chemicaliën te produceren, zoals alcoholen, zuren en aldehyden.
* Corrosie: Het roest van ijzer is een vorm van oxidatie, waarbij ijzer reageert met zuurstof om ijzeroxide te vormen.
Samenvattend , de hechting van zuurstof aan organische moleculen door oxidatie is een veelzijdig proces dat kan leiden tot verschillende veranderingen, variërend van energieproductie tot de vorming van nieuwe verbindingen en de afbraak van bestaande. Het is een essentieel proces in zowel biologische als industriële omgevingen.
 Superfundplan voor Columbia River leidt tot debat in Northwest
Superfundplan voor Columbia River leidt tot debat in Northwest  Is het waar dat vegetatie en bioom beide hetzelfde zijn?
Is het waar dat vegetatie en bioom beide hetzelfde zijn?  Afwegingen tussen voedselzekerheid en klimaatmitigatie
Afwegingen tussen voedselzekerheid en klimaatmitigatie Historische Britse landschappen ernstig bedreigd door klimaatcrisis
Historische Britse landschappen ernstig bedreigd door klimaatcrisis Dicht Antarctisch water keert terug naar de Atlantische Oceaan
Dicht Antarctisch water keert terug naar de Atlantische Oceaan
Hoofdlijnen
- Hoeveel theorieën zijn er en waarvoor?
- Antilichamen zijn eiwitmoleculen die zich hechten aan?
- Wat zijn drie voorbeelden van virussen die het genetische materiaal RNA bevatten?
- Hoe helpen computers wetenschappers meer te leren over bacteriën?
- Wat is chloorflukoolstof?
- Wanneer water door een celmembraan beweegt, heet dit?
- Hoe cilia worden georganiseerd:onderzoekers ontsluiten architectonische geheimen van ciliaire partities
- Hoe muggen menselijk zweet ruiken (en nieuwe manieren om ze te stoppen)
- Hoe isoleer je een beker water?
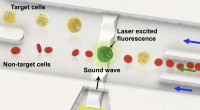
- Onderzoekers ontwikkelden sorteertechnologie op één celniveau met behulp van geluidsgolven
- Lithium-ionbatterijen krijgen meer efficiëntie dankzij silicium, germanium, koolstof nanowalls

- Nieuw voorgestelde strategie biedt slimme flexibele neurale elektrode met hoge efficiëntie
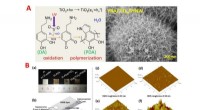
- Aangeraakt door licht:Foto-geëxciteerde stannylanionen zijn geweldig voor het produceren van organotinverbindingen

- Onderzoekers maken slim staal, 30% sterker

 Voorbereiding op een krachtigere deeltjesversneller
Voorbereiding op een krachtigere deeltjesversneller Wanneer is de zon direct boven Barbados?
Wanneer is de zon direct boven Barbados?  Het bacteriële sociale netwerk hacken
Het bacteriële sociale netwerk hacken Schuimt de zwavelzuuroplossing bij het mengen?
Schuimt de zwavelzuuroplossing bij het mengen?  Een fundamenteel nieuwe benadering van elektrostatisch ontwerp van materialen
Een fundamenteel nieuwe benadering van elektrostatisch ontwerp van materialen Bewakingscamera's binnenkort onherkenbaar
Bewakingscamera's binnenkort onherkenbaar Astronomen ontdekken gigantische relikwie van verstoord Tadpole-sterrenstelsel
Astronomen ontdekken gigantische relikwie van verstoord Tadpole-sterrenstelsel Hoe bacteriën mangaanoxide nanodeeltjes produceren
Hoe bacteriën mangaanoxide nanodeeltjes produceren
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

