
Wetenschap
Waarom pure NH3 verbrandt niet in lucht maar onzuiver PH3 -lucht?
1. Pure NH3 (ammoniak) brandt niet in lucht:
* Reden: Ammoniak is al een zeer geoxideerde verbinding. Het is moeilijk om het verder te oxideren in lucht om meer energie af te geven. Met andere woorden, er is niet genoeg energie die wordt vrijgegeven in de reactie om verbranding te behouden.
2. Pure pH3 (fosfine) is spontaan ontvlambaar in lucht:
* Reden: Fosfine is veel minder stabiel dan ammoniak. Het reageert gemakkelijk met zuurstof in de lucht, wat leidt tot een zeer exotherme reactie (veel warmte wordt vrijgegeven) en de afgifte van licht (het brandt).
3. Onzuiverheden in PH3 kunnen de ontvlambaarheid beïnvloeden:
* Hoewel puur fosfine brandbaar is, kan de aanwezigheid van onzuiverheden zoals difosfine (p₂h₄) het eigenlijk * meer * ontvlambaar maken. Difosfine is nog reactiever dan fosfine en kan spontane verbranding bij lagere concentraties veroorzaken.
Belangrijkste verschillen:
* Oxidatietoestand: Ammoniak heeft een hogere oxidatietoestand voor stikstof dan fosfine voor fosfor. Dit maakt het moeilijker om verder te oxideren.
* bindingssterkte: De P-H-binding in fosfine is zwakker dan de N-H-binding in ammoniak. Dit maakt fosfine meer vatbaar voor reageren met zuurstof.
Belangrijke opmerking: Hoewel puur fosfine ontvlambaar is, is het niet noodzakelijk een goed idee om ermee te experimenteren. Fosfine is zeer giftig en het is cruciaal om het met extreme zorg in goed geventileerde gebieden aan te kunnen.
Laat het me weten als je nog andere vragen hebt!
 Wat zijn fossle brandstoffen?
Wat zijn fossle brandstoffen?  Hackmanite verandert ook van kleur bij blootstelling aan nucleaire straling:geheugentracering maakt nieuwe toepassingen mogelijk
Hackmanite verandert ook van kleur bij blootstelling aan nucleaire straling:geheugentracering maakt nieuwe toepassingen mogelijk Waarom corroderen goud en platina niet in vochtige lucht?
Waarom corroderen goud en platina niet in vochtige lucht?  Hoe gebruik je perslucht?
Hoe gebruik je perslucht?  Wat gebeurt er met de PH-waarde van het reactiemengsel tijdens neutralisatie?
Wat gebeurt er met de PH-waarde van het reactiemengsel tijdens neutralisatie?
 NASA-satellietbeeld Tropische depressie Hector langwerpig, verzwakking
NASA-satellietbeeld Tropische depressie Hector langwerpig, verzwakking Convergentiewetenschap in het veranderende Noordpoolgebied
Convergentiewetenschap in het veranderende Noordpoolgebied  Wat is het verschil tussen cumuluswolken en cirruswolken?
Wat is het verschil tussen cumuluswolken en cirruswolken?
In de meeste gevallen betekenen cirrus en cumuluswolken allebei mooi weer. Er zijn echter duidelijke verschillen tussen deze twee typen wolken, waaronder verschillen in hoogte en vorm. De La
 Zal de pandemie-ervaring ons helpen de klimaatverandering aan te pakken?
Zal de pandemie-ervaring ons helpen de klimaatverandering aan te pakken? Onderzoekers creëren definitieve methode om door bosbranden besmette wijndruiven te detecteren
Onderzoekers creëren definitieve methode om door bosbranden besmette wijndruiven te detecteren
Hoofdlijnen
- Ontdekking vergroot het begrip hoe bacteriën zich verspreiden
- Welke verdeling brengt impulsen over van het centrale zenuwstelsel naar spieren of klieren?
- Wat is het belangrijkste onderdeel van het wetenschappelijke proces?
- Evolueren parasieten om geslachtsverschillen in gastheren te exploiteren?
- Doel van Cell Lysis Solution
- Hibernerende ribosomen helpen bacteriën te overleven
- Is bacteriofaag in de domein archaea?
- Wat is plaveiselepithelialisatie?
- Onderzoek laat zien hoe landbouwgronden de verspreiding van bijenziekten beïnvloeden
- Zelfherstellende vloeistof brengt nieuw leven in batterijalternatief
- Nieuwe coating kan grote gevolgen hebben voor lithiumbatterijen
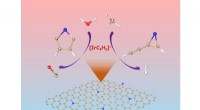
- Hoe twee isomeren van [IrC₄H₂]⁺ onafhankelijk reageren met methaan of water
- Natuurkundigen ontwikkelen ideale testomstandigheden voor zonnecellen voor ruimtetoepassingen

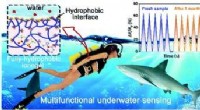
- Volledig hydrofobe ionogel ontwikkeld voor draagbare onderwatersensor en communicator
 Duurzame brandstofcellen maken
Duurzame brandstofcellen maken Waar kunt u Hunt Gems rocken in Idaho
Waar kunt u Hunt Gems rocken in Idaho  Is de productie van elektriciteit afhankelijk van de kracht van water?
Is de productie van elektriciteit afhankelijk van de kracht van water?  Wat is de procentuele samenstelling van calciumfluoride?
Wat is de procentuele samenstelling van calciumfluoride?  Team vindt storing die van invloed kan zijn op meer dan 100 wetenschappelijke onderzoeken
Team vindt storing die van invloed kan zijn op meer dan 100 wetenschappelijke onderzoeken Op 2D gebaseerde enkelvoudige fotonenzenders geïntegreerd met CMOS-compatibele siliciumnitride-golfgeleiders
Op 2D gebaseerde enkelvoudige fotonenzenders geïntegreerd met CMOS-compatibele siliciumnitride-golfgeleiders Hoe Calorimeter Constant te berekenen
Hoe Calorimeter Constant te berekenen Hoe verouderende klokken tikken:nieuwe studie wijst op stochastische veranderingen in cellen
Hoe verouderende klokken tikken:nieuwe studie wijst op stochastische veranderingen in cellen
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

