
Wetenschap
Welke groep elementen op het periodieke tabel is erg reactief en waarom?
Dit is waarom ze zo reactief zijn:
* Eén valentie -elektron: Alkali -metalen hebben slechts één elektron in hun buitenste schaal (valentieschaal). Dit enkele elektron wordt losjes vastgehouden en gemakkelijk verloren, waardoor ze enthousiast zijn om een positief ion te vormen (+1 lading).
* Lage ionisatie -energie: Er is heel weinig energie voor nodig om dit enkele valentie -elektron te verwijderen, waardoor ze zeer reactief zijn.
* Grote atoomradius: Hun grote atoomradius betekent dat het buitenste elektron ver van de kern is en minder strak gebonden is.
* Sterke elektropositieve aard: Alkali -metalen hebben een sterke neiging om elektronen te verliezen en positieve ionen te vormen, waardoor ze gemakkelijk reageren met andere elementen, vooral niet -metalen.
Voorbeelden van alkali -metalen:
* Lithium (li)
* Natrium (NA)
* Kalium (k)
* Rubidium (RB)
* Cesium (CS)
* Francium (fr)
Reactiviteit neemt de groep af:
Naarmate je de groep naar beneden gaat, neemt de reactiviteit van alkali -metalen toe. Dit komt omdat de atomaire straal toeneemt, waardoor het valentie -elektron nog verder van de kern wordt en gemakkelijker te verwijderen.
Veiligheidsnota: Alkali -metalen reageren gewelddadig met water en lucht, zodat ze met extreme voorzichtigheid moeten worden behandeld en worden opgeslagen in inerte atmosferen.
 Nieuwe katalysator voor het maken van brandstoffen uit schaliegas
Nieuwe katalysator voor het maken van brandstoffen uit schaliegas Hoe beïnvloedt het verhogen van de concentratie kaliumjodide en zwavelzuur de reactiesnelheid?
Hoe beïnvloedt het verhogen van de concentratie kaliumjodide en zwavelzuur de reactiesnelheid?  Superdichte pakking van waterstofmoleculen op een oppervlak
Superdichte pakking van waterstofmoleculen op een oppervlak Wat is de uitgebalanceerde vergelijking voor zilvernitraat plus natriumchloraat is gelijk aan chloraat?
Wat is de uitgebalanceerde vergelijking voor zilvernitraat plus natriumchloraat is gelijk aan chloraat?  Nieuwe tijdsopgeloste ultraviolette fotodissociatie-massaspectrometriestrategie voor analyse van de stabiliteit van doeleiwitten
Nieuwe tijdsopgeloste ultraviolette fotodissociatie-massaspectrometriestrategie voor analyse van de stabiliteit van doeleiwitten
 Kleine organismen werpen een groot licht op voedingsstoffen in de oceaan
Kleine organismen werpen een groot licht op voedingsstoffen in de oceaan Graduate research fellow onderzoekt hoe schimmels en vuur het ecosysteem van dennensavannes laten gedijen
Graduate research fellow onderzoekt hoe schimmels en vuur het ecosysteem van dennensavannes laten gedijen Earths 2017 resource budget besteed tegen 2 augustus:rapport
Earths 2017 resource budget besteed tegen 2 augustus:rapport Hoe kolibries de wind bestrijden:een robotapparaat helpt bij het analyseren van zwevende vogels
Hoe kolibries de wind bestrijden:een robotapparaat helpt bij het analyseren van zwevende vogels  Nieuwe methode voor het bestuderen van sediment kan de impact van klimaatverandering voorspellen
Nieuwe methode voor het bestuderen van sediment kan de impact van klimaatverandering voorspellen
Hoofdlijnen
- Natuuronderzoek laat zien hoe moleculen uit de kern ontsnappen
- Welke hormonen worden gemaakt door de achterste hypofyse?
- Welk vasculair weefsel draagt voedsel van de bladeren tot wortels?
- Wat is een kruisverwijzingssysteem?
- Wat is de basisstructuur van een neuron?
- Stropers richten zich op Afrikaanse leeuwen, gieren met vergif
- Uit onderzoek blijkt dat alle Afrikaanse carnivoren risico lopen op verlies van hun bereik
- Meer carrièremogelijkheden kunnen verklaren waarom minder vrouwen een baan in de wetenschap en wiskunde nastreven
- Wie bedacht de term zolaogie?
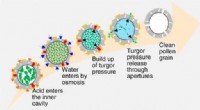
- Pollenschillen schoonmaken
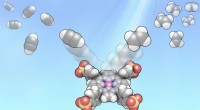
- Fotosynthese-geïnspireerd proces maakt basischemicaliën
- Op hematiet gebaseerde nanodraadstructuren om de conversie van zonne-energie naar brandstof bij foto-elektrochemische watersplitsing te verbeteren

- Fruitig met een vleugje schimmel:hoe schimmelinfecties het aroma van wijn veranderen

- Wetenschappers bepalen de bestemming voor eiwitten die zink leveren

 Hoeveel atomen van elk element in NH3?
Hoeveel atomen van elk element in NH3?  Kan genderongelijkheid dodelijk zijn? Paper kijkt naar impact bij oudere Indiase vrouwen
Kan genderongelijkheid dodelijk zijn? Paper kijkt naar impact bij oudere Indiase vrouwen Luchtvervuiling veroorzaakt door maïsproductie verhoogt sterftecijfer in VS
Luchtvervuiling veroorzaakt door maïsproductie verhoogt sterftecijfer in VS Radicale paaranalyse overwint de hindernis in de theorie van hoe vogels navigeren
Radicale paaranalyse overwint de hindernis in de theorie van hoe vogels navigeren  Emoji-huidtinten bevorderen diversiteit op Twitter
Emoji-huidtinten bevorderen diversiteit op Twitter Natuurkundige die bolvormige meteoorfragmenten vond, beweert dat ze afkomstig kunnen zijn van een buitenaards ruimteschip:dit is wat we ervan moeten denken
Natuurkundige die bolvormige meteoorfragmenten vond, beweert dat ze afkomstig kunnen zijn van een buitenaards ruimteschip:dit is wat we ervan moeten denken  Vindt er een reactie plaats als NiCl2(aq) wordt toegevoegd aan een reageerbuisje met Zn(NO3)2(aq)?
Vindt er een reactie plaats als NiCl2(aq) wordt toegevoegd aan een reageerbuisje met Zn(NO3)2(aq)?  Controleren hoe 'vreemde paar'-oppervlakken en vloeistoffen op elkaar inwerken
Controleren hoe 'vreemde paar'-oppervlakken en vloeistoffen op elkaar inwerken
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

