
Wetenschap
Wat is de relatie tussen het aantal gasdeeltjes en het volume?
Dit is waarom:
* Kinetische moleculaire theorie: De kinetische moleculaire theorie verklaart gasgedrag. Het stelt dat gasdeeltjes in constante willekeurige beweging zijn en een verwaarloosbaar volume hebben in vergelijking met de ruimte daartussen.
* botsingen en druk: Deze deeltjes botsen met de wanden van hun container, waardoor druk ontstaat. Meer deeltjes betekenen meer botsingen, wat leidt tot hogere druk.
* Constante druk handhaven: Om de druk constant te houden, moet de container uitbreiden om de verhoogde botsingen tegemoet te komen. Daarom neemt het volume toe.
Wiskundige weergave:
Deze relatie is ingekapseld in de ideale gaswet:
* pv =nrt
Waar:
* p is druk
* v is volume
* n is het aantal mol gas (recht evenredig met het aantal deeltjes)
* r is de ideale gasconstante
* t is temperatuur
Samenvattend:
Als u het aantal gasdeeltjes in een container verhoogt, terwijl de temperatuur- en drukconstant wordt gehouden, moet het volume van de container ook toenemen om de extra deeltjes op te nemen en het evenwicht te behouden.
 Zinktransporter sleutel tot het bestrijden van alvleesklierkanker en meer
Zinktransporter sleutel tot het bestrijden van alvleesklierkanker en meer Wanneer de interactie tussen vast kaliumpermanganaat en waterstofperoxide plaatsvindt, welk percentage ontstaat dan door zuurstofgas uit het productmengsel van waterdampzuurstof?
Wanneer de interactie tussen vast kaliumpermanganaat en waterstofperoxide plaatsvindt, welk percentage ontstaat dan door zuurstofgas uit het productmengsel van waterdampzuurstof?  Raman-microspectroscopie gebruiken om snel ziekteverwekkende bacteriën te detecteren
Raman-microspectroscopie gebruiken om snel ziekteverwekkende bacteriën te detecteren Is ductiel en kneedbaar een chemische eigenschap of een fysische eigenschap?
Is ductiel en kneedbaar een chemische eigenschap of een fysische eigenschap?  Wat betekent chemische volatiliteit op het veiligheidsgegevensblad?
Wat betekent chemische volatiliteit op het veiligheidsgegevensblad?
Hoofdlijnen
- Hoe in een laboratorium gekweekte huid werkt
- Uit onderzoek blijkt hoe vrouwtjes het 'juiste' sperma kiezen
- Onderzoekers werpen licht op hoe een belangrijk ingrediënt voor leven zich in de ruimte kan vormen
- Wat zijn feiten over wat een wetenschappers doen?
- Wat is het voordeel van zaadkieming voor de mens?
- Wat is de functie van sucrose bij DNA -extractie?
- Zijn rode algen en voorbeeld van een organisme uit de flagellate groep?
- Honden kunnen dementie krijgen, maar veel wandelen kan het risico verlagen
- Wat is een lichaamsbuis in een microscoop?
- Glanzende megakristallen die zichzelf bouwen

- Inerte stikstof gedwongen om met zichzelf te reageren
- Onderzoek naar elektrolyse voor energieopslag
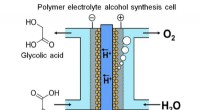
- Onderzoek kan ertoe bijdragen dat flexibele technologie langer meegaat, vermijd kritieke storingen

- Eerste flexibele geheugenapparaat dat ferro-elektrisch materiaal van oxide gebruikt

 Een pleister voor het hart? Nieuwe 3D-printmethode maakt dit, en nog veel meer, mogelijk
Een pleister voor het hart? Nieuwe 3D-printmethode maakt dit, en nog veel meer, mogelijk  Magnetische nanodeeltjes om gelijktijdig te diagnosticeren, bewaken en behandelen
Magnetische nanodeeltjes om gelijktijdig te diagnosticeren, bewaken en behandelen Wat is het aantal niet -bindende elektronenparen op Central Atom NH2CL?
Wat is het aantal niet -bindende elektronenparen op Central Atom NH2CL?  Wat is de vergelijking van bedrag vocht in de lucht daarmee kan vasthouden?
Wat is de vergelijking van bedrag vocht in de lucht daarmee kan vasthouden?  Hoeveel water is nodig om zout op te lossen?
Hoeveel water is nodig om zout op te lossen?  Nokia schrapt meer banen omdat snelle netwerkdeals langzaam komen
Nokia schrapt meer banen omdat snelle netwerkdeals langzaam komen Facebook neemt het op tegen IRS in belastingzaak met groot ticket
Facebook neemt het op tegen IRS in belastingzaak met groot ticket Mengsels die niet gelijkmatig worden gemengd maar niet gemakkelijk kunnen worden gescheiden door te filteren -a -Alys-B-Suspensions-Colloids-D-Solutions?
Mengsels die niet gelijkmatig worden gemengd maar niet gemakkelijk kunnen worden gescheiden door te filteren -a -Alys-B-Suspensions-Colloids-D-Solutions?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

