
Wetenschap
Hoeveel elektronen moet een halogeen wonen om stabiliteit te bereiken?
Dit is waarom:
* Elektronenconfiguratie: Halogenen staan in groep 17 van de periodiek systeem. Ze hebben zeven valentie -elektronen (elektronen in hun buitenste schaal).
* octetregel: Atomen streven ernaar een stabiele elektronenconfiguratie te bereiken zoals die van edelgassen. Nobele gassen hebben een volledige buitenste schaal van acht elektronen (behalve helium, die er twee heeft).
* een elektron winnen: Door één elektron te winnen, voltooien halogenen hun buitenste schaal en bereiken ze de stabiele elektronenconfiguratie van het dichtstbijzijnde edelgas.
Bijvoorbeeld:
* Chloor (CL) heeft 7 valentie -elektronen. Door één elektron te winnen, wordt het Cl⁻ met 8 valentie -elektronen, zoals het edelgas argon (AR).
* Fluor (F) heeft 7 valentie -elektronen. Door één elektron te winnen, wordt het F⁻ met 8 valentie -elektronen, zoals de Noble Gas Neon (NE).
 Wat is de balans voor formule CH4 F2 ---- HF CHF3?
Wat is de balans voor formule CH4 F2 ---- HF CHF3?  Hoe een natuurlijke verbinding uit zakpijpen kanker bestrijdt
Hoe een natuurlijke verbinding uit zakpijpen kanker bestrijdt  Nieuw staal om de levensduur van olieveldpijpleidingen te verdubbelen
Nieuw staal om de levensduur van olieveldpijpleidingen te verdubbelen Voorgestelde technische methode kan gebouwen en bruggen veiliger maken
Voorgestelde technische methode kan gebouwen en bruggen veiliger maken Twee Frank-Kasper-fasen in zoutkristalstructuren waargenomen
Twee Frank-Kasper-fasen in zoutkristalstructuren waargenomen
 Vijf manieren om kritisch landverval te stoppen
Vijf manieren om kritisch landverval te stoppen Nepal verliest van China terwijl Everest-operators de berg oversteken
Nepal verliest van China terwijl Everest-operators de berg oversteken Groot-Brittannië stelt deadline voor koolstofneutraliteit in 2050
Groot-Brittannië stelt deadline voor koolstofneutraliteit in 2050 Mist zorgt voor water in de droogste zones ter wereld
Mist zorgt voor water in de droogste zones ter wereld  Een toekomst voorstellen waarin alle bomen in Europa verdwijnen
Een toekomst voorstellen waarin alle bomen in Europa verdwijnen
Hoofdlijnen
- Wat zijn de sterke en zwakke punten van theorie -evolutie?
- Wat betekent een wetenschapper en niet-wetenschapper volgens theorie?
- Om de biosfeer voor toekomstige generaties te behouden, moeten mensen -?
- Wat is de beste manier om de overdracht van tuberculose door in het wild levende runderen te voorkomen?
- Wetenschappers identificeren hoe belangrijke eiwitten chronische infecties onder controle houden
- Gistonderzoek biedt een mogelijk antwoord op de vraag waarom sommige soorten generalisten zijn en andere specialisten
- Waarom het zo moeilijk is om schepen bij te houden die niets goeds doen?
- Nieuw onderzoek laat zien hoe dicamba veilig kan worden gebruikt in suikermaïs
- Wat is er allemaal betrokken bij de kern?
- Onderzoek naar kant-en-klare therapeutische voeding streeft naar drastische vermindering van sterfgevallen door ernstige acute ondervoeding

- Onderzoekers vinden krachtige chemische middelen die de uitzaaiing van kanker kunnen dwarsbomen

- Nieuwe fotokatalysatoren kunnen door zonne-energie aangedreven omzetting van koolstofdioxide in brandstof uitvoeren

- Nooit eerder geziene glasschade op nanoniveau zien

- Vloeibaar metaal bewezen goedkope en efficiënte CO2-converter
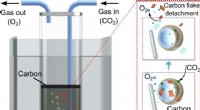
 Multifunctionele poreuze geleidende membranen helpen microben zich een weg te banen naar een snellere omzetting van kooldioxide
Multifunctionele poreuze geleidende membranen helpen microben zich een weg te banen naar een snellere omzetting van kooldioxide Waarom is katoen absorberend?
Waarom is katoen absorberend?  Hoe vermindert het zaagsel het smeltpunt van ijs?
Hoe vermindert het zaagsel het smeltpunt van ijs?  Hoeveel bases heeft een dubbele helix nadat de complementaire streng is toegevoegd?
Hoeveel bases heeft een dubbele helix nadat de complementaire streng is toegevoegd?  Welk type binding bevat natrium- en cholride -atomen bij elkaar wanneer ze interageren met chlooratomen?
Welk type binding bevat natrium- en cholride -atomen bij elkaar wanneer ze interageren met chlooratomen?  Spinstroom uit warmte - nieuw materiaal verhoogt de efficiëntie
Spinstroom uit warmte - nieuw materiaal verhoogt de efficiëntie Uit onderzoek blijkt dat niet alle mislukkingen tot leren leiden
Uit onderzoek blijkt dat niet alle mislukkingen tot leren leiden  Natuurkundigen creëren een nieuwe klasse van 2D kunstmatige materialen
Natuurkundigen creëren een nieuwe klasse van 2D kunstmatige materialen
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

