
Wetenschap
Worden niet -metalen reactiever wanneer ze naar links gaan naar rechts?
* elektronegativiteit: Niet -metalen hebben een hogere elektronegativiteit dan metalen. Dit betekent dat ze een sterkere aantrekkingskracht hebben op elektronen. Naarmate u zich over een periode beweegt, neemt de elektronegativiteit van niet -metalen toe.
* ionisatie -energie: Niet -metalen hebben ook hogere ionisatie -energieën. Dit betekent dat er meer energie nodig is om een elektron uit een niet -metaalatoom te verwijderen. Terwijl u zich over een periode beweegt, neemt de ionisatie -energie toe.
* Elektronenaffiniteit: Niet -metalen hebben over het algemeen een hoge elektronenaffiniteit, wat betekent dat ze gemakkelijk elektronen krijgen om negatieve ionen (anionen) te vormen. Deze neiging om elektronen te winnen neemt toe naarmate u zich over een periode beweegt.
Waarom dit leidt tot verhoogde reactiviteit:
* neiging om elektronen te winnen: Met hogere elektronegativiteit en elektronenaffiniteit worden niet -metalen waarschijnlijker om elektronen aan te trekken en te winnen van andere atomen. Dit betekent dat ze gemakkelijk bindingen vormen met andere atomen, vooral met metalen, wat leidt tot meer reactieve interacties.
* sterkere bindingen: Hogere ionisatie -energieën betekenen dat de elektronen in niet -metalen nauwer worden vastgehouden. Wanneer ze bindingen vormen, zijn deze bindingen over het algemeen sterker en zijn ze minder kans om gemakkelijk te breken. Dit kan bijdragen aan een meer krachtige reactie.
Voorbeeld:
- Fluor (F) is het meest reactieve niet -metaal in de periodiek systeem. Het bevindt zich het verst op het periodiek systeem en heeft de hoogste elektronegativiteit en elektronenaffiniteit van alle elementen.
Belangrijke opmerking: Hoewel de trend over het algemeen waar is, zijn er enkele uitzonderingen en nuances op deze regel. Sommige niet -metalen kunnen bijvoorbeeld reactiever zijn vanwege hun unieke atoomstructuren of andere factoren.
 Welke oplossing met een lage concentratie opgeloste stof?
Welke oplossing met een lage concentratie opgeloste stof?  Het geheim van de beste seizoensgebonden warme chocolademelk? Het zit allemaal in de chemie!
Het geheim van de beste seizoensgebonden warme chocolademelk? Het zit allemaal in de chemie! Welk type wetenschapper bestudeert waterstof en zuurstof?
Welk type wetenschapper bestudeert waterstof en zuurstof?  Nieuwe techniek belooft verbeterde detectie van uitgezaaide prostaatkanker
Nieuwe techniek belooft verbeterde detectie van uitgezaaide prostaatkanker Micro-brouwen gaat meer micro
Micro-brouwen gaat meer micro
 Hoe kunt u de natuur beschermen?
Hoe kunt u de natuur beschermen?  UITLEG:Was de uitbraak van een tornado gerelateerd aan de klimaatverandering?
UITLEG:Was de uitbraak van een tornado gerelateerd aan de klimaatverandering?  Nieuw algoritme geeft meer gedetailleerde kijk op stedelijke hitte-eilanden
Nieuw algoritme geeft meer gedetailleerde kijk op stedelijke hitte-eilanden De kloof dichten:burgerwetenschap voor het monitoren van duurzame ontwikkeling
De kloof dichten:burgerwetenschap voor het monitoren van duurzame ontwikkeling Overeenkomsten en verschillen tussen kikkers en padden
Overeenkomsten en verschillen tussen kikkers en padden
Hoofdlijnen
- Hoeveel krijgt een wetenschapper betaald door de biologie?
- Nieuw onderzoek naar spermastamcellen heeft gevolgen voor mannelijke onvruchtbaarheid en kanker
- Welke kenmerken van de bladeren helpen het meeste voedsel te maken door fotosynthese?
- Wat is predicetatie?
- Onderzoek bij wormen biedt een model om te bestuderen hoe het microbioom de ziekte bij mensen beïnvloedt
- Welke functie hebben co-enzymen bij de ademhaling?
- Nieuwe forensische methode heeft tot doel te voorspellen hoe een persoon eruit ziet op basis van een DNA-monster
- Wat zijn de essentiële reproductiegeorganen?
- Welke veranderingen in de cellulaire ademhaling kun je verwachten in slapende zaden?
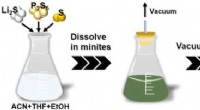
- Ontwikkeling van een nieuwe grootschalige productietechnologie voor sulfide vaste elektrolyten
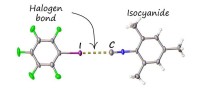
- Nieuwe niet-covalente binding blokkeert de afstotende geur van isocyaniden
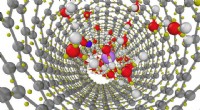
- Een keramische aerogel gemaakt met nanokristallen en ingebed in een matrix voor gebruik in thermische isolatietoepassingen

- Groene chemie creëert coatings uit de natuur

- De effecten van nano-opsluiting op water lokaliseren
 Witte Huis OK's melden waarschuwing klimaatverandering veroorzaakt door mensen
Witte Huis OK's melden waarschuwing klimaatverandering veroorzaakt door mensen Onderzoeker vecht met Schotse bezem
Onderzoeker vecht met Schotse bezem Extreme ultraviolette beeldvorming toont potentieel om onderzoek naar de ziekte van Alzheimer te verbeteren
Extreme ultraviolette beeldvorming toont potentieel om onderzoek naar de ziekte van Alzheimer te verbeteren Nieuwe scanning transmissie-elektronenmicroscopen voor medisch en materiaalonderzoek
Nieuwe scanning transmissie-elektronenmicroscopen voor medisch en materiaalonderzoek Wanneer licht door dit soort materiaal gaat, verspreidt het zich?
Wanneer licht door dit soort materiaal gaat, verspreidt het zich?  Welke twee groepen zijn nauw verwant evolutionair planten en dieren schimmels?
Welke twee groepen zijn nauw verwant evolutionair planten en dieren schimmels?  Hoe worden braamzaden verspreid door dieren?
Hoe worden braamzaden verspreid door dieren?  Bewerkfunctie voor Twitter-readies voor premium gebruikers
Bewerkfunctie voor Twitter-readies voor premium gebruikers
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

