
Wetenschap
Waarom zijn Imides zuurder dan amiden?
1. Elektronen-withending effect van de tweede carbonylgroep:
* Imides hebben twee carbonylgroepen bevestigd aan het stikstofatoom, terwijl amiden er maar één hebben.
* De twee carbonylgroepen in Imides hebben een sterk elektronen-withending effect op het stikstofatoom.
* Deze elektronenonttrekking verhoogt de positieve lading op de stikstof, waardoor het voor de stikstof gemakkelijker is om een proton te doneren (H+).
2. Resonantiestabilisatie van het anion:
* Wanneer een imide een proton verliest, wordt het resulterende anion gestabiliseerd door resonantie.
* De negatieve lading kan delocaliseren over beide carbonylgroepen, waardoor de lading over een groter gebied wordt gedistribueerd.
* Deze resonantie -stabilisatie maakt het anion stabieler en bevordert het deprotonatieproces.
3. Inductief effect:
* De carbonylgroepen in zowel Imides als Amides hebben een sterk inductief effect, waardoor elektronendichtheid van de stikstof wordt verwijderd.
* De aanwezigheid van twee carbonylgroepen in Imides leidt echter tot een sterker inductief effect in vergelijking met amiden.
* Deze verhoogde elektronenonttrekking maakt de stikstof in Imides zuurder.
4. Sterische factoren:
* De sterische belemmering rond het stikstofatoom bij Imides kan ook bijdragen aan hun zuurgraad.
* De twee carbonylgroepen kunnen de nadering van een basis belemmeren, waardoor het proton toegankelijker wordt voor verwijdering.
Samenvattend:
De combinatie van het elektronen-withending effect van twee carbonylgroepen, resonantie-stabilisatie van het anion en inductieve effecten maakt Imides zuurder dan amiden. De zuurgraad van Imides wordt weerspiegeld in hun PKA -waarden, die meestal lager zijn dan die van amiden.
Hoofdlijnen
- Hoe kunnen we het gebruik van pesticiden terugdringen en boeren tegelijk empoweren? Een genuanceerder aanpak zou kunnen helpen
- Wat is een lipide dat fosfor en structurele component in celmembranen bevat?
- Wiskundige modellen laten zien hoe chitinase, een moleculaire monorail, eenrichtingsverkeer gehoorzaamt
- Waarom worden plantenhormonen gebruikt?
- Variatie is belangrijk:genetische effecten bij op elkaar inwerkende soorten bepalen samen ecologische resultaten
- Verdediging tegen bijna elke prijs
- Cellen puilen uit om door barrières te persen
- Nieuwe studie identificeert genetische basis voor resistentie tegen maïswortelwormen in maïs
- Wat zijn de twee hoofdfasen van celdeling?
- Nieuwe methode vereenvoudigt het zoeken naar eiwitreceptorcomplexen, de ontwikkeling van medicijnen versnellen

- Analytische methoden helpen bij het ontwikkelen van tegengiffen voor cyanide, mosterdgas

- Decennia lang onderzoek mondt uit in een nieuwe manier om links- en rechtshandige moleculen te maken

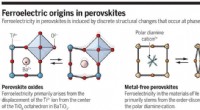
- Een manier om tegen lage kosten schonere metaalvrije perovskieten te maken
- Moleculaire volumeregeling
 Als exoplaneten bliksem hebben, zal dat de zoektocht naar leven bemoeilijken
Als exoplaneten bliksem hebben, zal dat de zoektocht naar leven bemoeilijken  Hoeveel ons is 235 ml?
Hoeveel ons is 235 ml?  Wat voor soort energie wordt door een kaars afgegeven?
Wat voor soort energie wordt door een kaars afgegeven?  Hoe Ghostbusters werken
Hoe Ghostbusters werken  Kunnen we de communicatie afluisteren die door ons zonnestelsel gaat?
Kunnen we de communicatie afluisteren die door ons zonnestelsel gaat?  Wat zijn de kenmerken van de biosfeer?
Wat zijn de kenmerken van de biosfeer?  Warren Buffett zegt dat steenkool geen comeback zal maken
Warren Buffett zegt dat steenkool geen comeback zal maken Van de bosbranden tot het coronavirus, ons oude normaal is voor altijd weg
Van de bosbranden tot het coronavirus, ons oude normaal is voor altijd weg
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com


