
Wetenschap
Welk element deelt de meeste kenmerken met koolstof?
* Vergelijkbare elektronische configuratie: Zowel koolstof als silicium hebben vier valentie -elektronen, de elektronen die betrokken zijn bij de binding. Hierdoor kunnen ze vier covalente bindingen vormen, waardoor een breed scala aan verbindingen ontstaat.
* Mogelijkheid om ketens en ringen te vormen: Net als koolstof kan silicium lange ketens en ringstructuren vormen, wat leidt tot het creëren van complexe moleculen. Dit is een belangrijk kenmerk bij de vorming van organische moleculen en wordt ook gezien in op siliconen gebaseerde polymeren en keramiek.
* Vergelijkbare bindingseigenschappen: Beide elementen kunnen enkele, dubbele en drievoudige bindingen vormen. Ze kunnen ook banden vormen met verschillende andere elementen, wat leidt tot een divers scala aan verbindingen.
* overvloedig van aard: Zowel koolstof als silicium zijn relatief overvloedig in de korst van de aarde.
* Basis voor technologie: Koolstof is de ruggengraat van organische chemie en leven zelf. Silicium is de basis van de halfgeleiderindustrie, cruciaal voor moderne elektronica.
Hoewel silicium veel overeenkomsten met koolstof deelt, zijn er ook belangrijke verschillen:
* bindingssterkte: Silicium-siliciumbindingen zijn zwakker dan koolstof-koolstofbindingen, wat leidt tot minder stabiele en minder complexe structuren.
* Reactiviteit: Silicium is over het algemeen minder reactief dan koolstof en vormt gemakkelijker bindingen met zuurstof.
Over het algemeen maken de overeenkomsten in hun elektronische configuraties en bindingseigenschappen silicium het dichtst bij de elementaire analoog aan koolstof.
 Nieuw boek beschrijft hoe de walvisjacht de Amerikaanse cultuur heeft gevormd, zelfs nadat aardolie deze had vervangen
Nieuw boek beschrijft hoe de walvisjacht de Amerikaanse cultuur heeft gevormd, zelfs nadat aardolie deze had vervangen  NASA toont winden die de ondergang van tropische cycloon Lornas veroorzaken
NASA toont winden die de ondergang van tropische cycloon Lornas veroorzaken Overstromingsgevoelig Miami om miljarden uit te geven om zeespiegelstijging aan te pakken
Overstromingsgevoelig Miami om miljarden uit te geven om zeespiegelstijging aan te pakken Voorspelling van grote kans op aardbevingen verbeterd
Voorspelling van grote kans op aardbevingen verbeterd Verzoening van de doelstellingen van het Akkoord van Parijs voor temperatuur, emissies - uit onderzoek blijkt dat twee doelen niet altijd hand in hand gaan
Verzoening van de doelstellingen van het Akkoord van Parijs voor temperatuur, emissies - uit onderzoek blijkt dat twee doelen niet altijd hand in hand gaan
Hoofdlijnen
- Hoe planten hun symbiotische partners vinden
- Welke soorten cellen delen door mitose en cytokinese?
- Australische soorten hebben een onafhankelijke kampioen nodig
- Hoe wetenschappers het Cheerios-effect omkeerden
- Hoe empathie werkt
- Onderzoek details genetische resistentie tegen plotselinge dood syndroom in sojabonen
- Mieren in het bladerdak van het Amazone-regenwoud hebben veel meer bacteriën in hun ingewanden dan grondbewoners
- Wetenschappers onthullen de prachtige eenvoud die ten grondslag ligt aan vertakkingspatronen in weefsel
- Moleculaire biologie:zijn snel prolifererende cellen epigenetisch kneedbaar?
- Eenvoudige methode om koolstofdioxide om te zetten in bruikbare verbindingen

- Nieuwe materialen met een hoge zuurstof-ionengeleiding die een duurzame toekomst opent
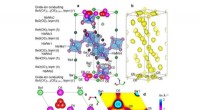
- Op oxide-zeoliet gebaseerd composietkatalysatorconcept maakt syngaschemie mogelijk die verder gaat dan Fischer-Tropsch-synthese
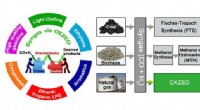
- Catalyst opent deur naar efficiënter, milieuvriendelijke ethyleenproductie
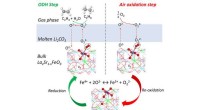
- Het aangaan van een 100 jaar oude uitdaging zou de weg kunnen banen naar digitale aroma's

 Factoren die veranderen in een experiment?
Factoren die veranderen in een experiment?  Wat weerhoudt de planeten in jouw zonnestelsel ervan om weg te drijven?
Wat weerhoudt de planeten in jouw zonnestelsel ervan om weg te drijven?  Hoe kan het hoofd meer warmte produceren?
Hoe kan het hoofd meer warmte produceren?  Meststoffen passen de stikstofcyclus van prairieplanten aan, volgens nieuwe studie
Meststoffen passen de stikstofcyclus van prairieplanten aan, volgens nieuwe studie Nanodeeltjes bieden inzicht in interacties tussen enkelstrengs DNA en hun bindende eiwitten
Nanodeeltjes bieden inzicht in interacties tussen enkelstrengs DNA en hun bindende eiwitten Waarom creëren zink en koper een hogere spanning dan in een circuit?
Waarom creëren zink en koper een hogere spanning dan in een circuit?  Discovery verbetert de warmteoverdracht bij het koken
Discovery verbetert de warmteoverdracht bij het koken Hoe benzine werkt
Hoe benzine werkt
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

