
Wetenschap
Hoe kun je converteren van moleculen naar gram?
1. Begrijp de verbinding
* moleculen: De kleinste eenheid van een verbinding die de chemische eigenschappen van die verbinding behoudt.
* gram: Een massa -eenheid.
De sleutel tot het overbruggen van de opening is de mol (mol) .
* Avogadro's nummer: Eén mol van elke stof bevat 6,022 x 10^23 deeltjes (atomen, moleculen, ionen, enz.). Dit is een enorm nummer, maar het maakt gemakkelijke conversies mogelijk.
2. Conversie stappen
1. Converteer moleculen in mol: Verdeel het aantal moleculen door het nummer van Avogadro.
2. Bereken molaire massa: Zoek de molaire massa van de verbinding (de massa van één mol) door de atomaire massa's van alle atomen in de verbinding toe te voegen. U kunt atomaire massa's vinden op het periodieke tabel.
3. Converteer mol naar gram: Vermenigvuldig het aantal mol met de molaire massa.
Voorbeeld:hoeveel gram zijn er in 1,5 x 10^24 moleculen water (h₂o)?
1. Moleculen tot mol:
* 1,5 x 10^24 moleculen / 6.022 x 10^23 moleculen / mol =2,49 mol
2. Molaire watermassa:
* H:1,01 g/mol (x2 voor twee waterstofatomen) =2,02 g/mol
* O:16.00 g/mol
* Totale molaire massa (H₂o):2,02 g/mol + 16,00 g/mol =18,02 g/mol
3. Mols to Grams:
* 2.49 mol x 18,02 g/mol =44,9 g
Daarom wegen 1,5 x 10^24 watermoleculen 44,9 gram.
Sleutelpunten:
* eenheden zijn cruciaal! Zorg ervoor dat u de eenheden tijdens de berekening bijhoudt om ervoor te zorgen dat u eindigt met gram.
* Periodieke tabel: Gebruik het periodiek systeem om de atomaire massa's elementen te vinden.
* rekenmachine: Gebruik een wetenschappelijke rekenmachine voor grote getallen.
Laat het me weten als je een ander voorbeeld wilt proberen!
 Hoeveel equivalente Lewis-structuren zijn nodig om de binding in BrO4 te beschrijven?
Hoeveel equivalente Lewis-structuren zijn nodig om de binding in BrO4 te beschrijven?  Levende organismen zijn gemaakt van moleculen die grotendeels bestaan uit het element waterstof, stikstof, zuurstof, fosfor, zwavel en?
Levende organismen zijn gemaakt van moleculen die grotendeels bestaan uit het element waterstof, stikstof, zuurstof, fosfor, zwavel en?  Onderzoekers ontdekken methode om kalkaanslag te voorkomen
Onderzoekers ontdekken methode om kalkaanslag te voorkomen PFAS forever chemicaliën omzetten in waardevolle verbindingen
PFAS forever chemicaliën omzetten in waardevolle verbindingen  Video:Sublieme geheimen van sushi
Video:Sublieme geheimen van sushi
Hoofdlijnen
- Welke rol spelen genetica en milieu bij de ontwikkeling van een organisme?
- Lysosoom: definitie, structuur en functie
- Wiens stem is dat? Wetenschappers ontdekken 'stemgebied' in de hersenen van niet-menselijke primaten
- Anatomie en fysiologie van een synapsenstructuur
- Sommige planten worden groter - en gemener - als ze worden geknipt, studie vondsten
- Rechtbank vindt het goed om een soort uil te doden om het effect op andere uilen te zien
- Zijn nieuwe koralen in Sydney gevaarlijke indringers of ongevaarlijke vluchtelingen?
- Hoe heet de studie van een fysieke structuur van mensen of andere dieren?
- Wie is de eerste persoon gebruikte term cel?
- Huidpleister kan pijnloos vaccins afgeven, kankermedicatie in één minuut

- Wetenschappers maximaliseren de effectiviteit van platina in brandstofcellen

- Draagbare gasdetectie krimpt naar nieuwe dimensies

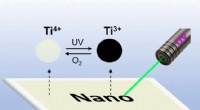
- Schrijven met licht op titanium:herschrijfbare UV-gevoelige oppervlakken gemaakt van gedoteerde TiO2-nanokristallen
- Nieuw effectief en veilig antischimmelmiddel geïsoleerd uit het microbioom van de waterpijp

 Nu de klimaatverandering in het Midwesten minder duidelijk zichtbaar is, willen parkbezoekers weten welke gevolgen de lokale hulpbronnen hebben
Nu de klimaatverandering in het Midwesten minder duidelijk zichtbaar is, willen parkbezoekers weten welke gevolgen de lokale hulpbronnen hebben  Sperma getest als mogelijke kandidaat voor het afleveren van kankermedicatie bij vrouwelijke patiënten
Sperma getest als mogelijke kandidaat voor het afleveren van kankermedicatie bij vrouwelijke patiënten Draait de aarde aan de bovenkant langzamer of sneller?
Draait de aarde aan de bovenkant langzamer of sneller?  Hoe kunnen we nikkel besparen?
Hoe kunnen we nikkel besparen?  Zijn tijd- en temperatuurvoorbeelden van basis -SI- of metrische eenheden?
Zijn tijd- en temperatuurvoorbeelden van basis -SI- of metrische eenheden?  Een schapenmelksmoothie serveren
Een schapenmelksmoothie serveren Spuitbare gel kan het lichaam helpen kanker na een operatie te bestrijden
Spuitbare gel kan het lichaam helpen kanker na een operatie te bestrijden Een metabolische route die leverkanker voedt
Een metabolische route die leverkanker voedt
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

