
Wetenschap
Wat gebeurt er met het oorspronkelijke natrium en chloor na het chloor-alkaliproces?
Natrium (Na): De natriumionen (Na+) in NaCl worden tijdens de elektrolyse aan de kathode (negatieve elektrode) gereduceerd. Reductie omvat het verkrijgen van elektronen, dus elk Na+-ion krijgt één elektron om een neutraal natriumatoom (Na) te worden. Deze natriumatomen reageren vervolgens met water (H₂O) dat aanwezig is in de elektrolytische oplossing en vormen natriumhydroxide (NaOH) en waterstofgas (H₂). De algemene reactie voor dit proces is:
2Na+ + 2H₂O + 2e- → 2NaOH + H₂
Chloor (Cl): De chloride-ionen (Cl-) in NaCl worden tijdens elektrolyse aan de anode (positieve elektrode) geoxideerd. Bij oxidatie gaat het om het verlies van elektronen, dus verliest elk Cl-ion één elektron om een neutraal chlooratoom (Cl) te worden. Deze chlooratomen reageren vervolgens met elkaar en vormen chloorgas (Cl₂), dat als product van de elektrolyse vrijkomt. De algemene reactie voor dit proces is:
2Cl- → Cl₂ + 2e-
Daarom worden de oorspronkelijke natriumionen uit NaCl omgezet in natriumatomen, die reageren met water om natriumhydroxide te vormen. De oorspronkelijke chloride-ionen uit NaCl worden omgezet in neutrale chlooratomen, die samen chloorgas vormen. Deze producten, natriumhydroxide en chloorgas, zijn de waardevolle eindproducten van het chloor-alkaliproces en worden veel gebruikt in verschillende industrieën.
 Waarom verspreidt een druppel olie die op het oppervlaktewater wordt geplaatst zich over het hele oppervlak?
Waarom verspreidt een druppel olie die op het oppervlaktewater wordt geplaatst zich over het hele oppervlak?  Snelle urinetest voor amfetaminen stuurt resultaten via app
Snelle urinetest voor amfetaminen stuurt resultaten via app Toppen van waterige golven kunnen essentiële chemicaliën transporteren in een industrieel scheidingsproces
Toppen van waterige golven kunnen essentiële chemicaliën transporteren in een industrieel scheidingsproces Een milieuvriendelijke, goedkope oplossing voor afvalwaterzuivering
Een milieuvriendelijke, goedkope oplossing voor afvalwaterzuivering Verschillen tussen Polycrylic & Polyurethane
Verschillen tussen Polycrylic & Polyurethane
 Stijgende temperaturen veranderen wanneer en hoeveel mensen naar buiten gaan op openbare gronden
Stijgende temperaturen veranderen wanneer en hoeveel mensen naar buiten gaan op openbare gronden Nieuw onderzoek suggereert dat koralen moleculen produceren die ziekten kunnen helpen weerstaan
Nieuw onderzoek suggereert dat koralen moleculen produceren die ziekten kunnen helpen weerstaan Heeft de laatste ijstijd invloed gehad op de borstvoeding bij indianen?
Heeft de laatste ijstijd invloed gehad op de borstvoeding bij indianen?  Vouwfouten en seismisch risico in het Kunlun-bereik, Noordwest-Tibet
Vouwfouten en seismisch risico in het Kunlun-bereik, Noordwest-Tibet Wat is een natuurlijke haven en welke invloed heeft deze op het milieu?
Wat is een natuurlijke haven en welke invloed heeft deze op het milieu?
Hoofdlijnen
- Ongewenste getransformeerde cellen verwijderen:mogelijke nieuwe richtingen in kankertherapie
- Wat is de juiste uitspraak over bryofyten? A hebben gespecialiseerde weefsels die water geleiden. B. Opgenomen door osmose. C. Zijn niet erg afhankelijk van de D-plantengroep bestaande uit algen en mossen.
- Onderzoek onthult enkele geheimen over hoe microben en hun genen de wereld rondreizen
- Voelen planten pijn?
- Waarom uw dierenarts kan weigeren uw huisdier te euthanaseren
- Waarom het twintig jaar duurde om het menselijk genoom ‘af te maken’ – en waarom er nog meer te doen is
- Virussen herbedraden cellulaire machines van de gastheer om de virale productie te maximaliseren
- Wat biologen nog steeds niet weten over bioluminescentie
- Wat is een voorbeeld van bindweefsel?
- Moeten onderwijs en communicatie over de vooruitgang van microfluïdica worden verbeterd?

- Nieuwe polymeermaterialen maken het vervaardigen van optische verbindingen eenvoudiger
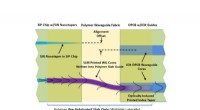
- Een exotische microbe en een ongebruikelijk extractieproces kunnen samen een economische manier zijn om een veelbelovende biobrandstof te maken

- Onderzoekers ontwikkelen een reactor die chemicaliën voor altijd kan vernietigen

- Chemisten HAT-truc voor groenere chemische synthese
 Social gaming voor een betere energie-efficiëntie in openbare gebouwen
Social gaming voor een betere energie-efficiëntie in openbare gebouwen Simulatie suggereert zwaartekrachtinteracties die de melkwegstelsels uitpuilen
Simulatie suggereert zwaartekrachtinteracties die de melkwegstelsels uitpuilen Welk apparaat zet zonne-energie om in elektriciteit?
Welk apparaat zet zonne-energie om in elektriciteit?  Garens bedekt met enzymen kunnen als filters werken
Garens bedekt met enzymen kunnen als filters werken T. rex niet zo slim als eerder werd beweerd, vinden wetenschappers
T. rex niet zo slim als eerder werd beweerd, vinden wetenschappers  Als je van grote hoogte het water raakt, zal de impact je dan doden?
Als je van grote hoogte het water raakt, zal de impact je dan doden?  Waarom complottheorieën kunnen fungeren als radicaliseringsvermenigvuldigers van extreemrechtse idealen
Waarom complottheorieën kunnen fungeren als radicaliseringsvermenigvuldigers van extreemrechtse idealen Hoe luchtvaartmaatschappijen werken
Hoe luchtvaartmaatschappijen werken
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

