
Wetenschap
Waarom is waterstofchloride polair?
In waterstofchloride is de elektronegativiteit van chloor 3,0, terwijl de elektronegativiteit van waterstof 2,1 is. Dit betekent dat chloor een sterkere aantrekkingskracht heeft op elektronen dan waterstof. Als gevolg hiervan worden de elektronen in het waterstofchloridemolecuul naar het chlooratoom getrokken, waardoor een polaire binding ontstaat.
De polaire binding in waterstofchloride creëert een positieve lading op het waterstofatoom en een negatieve lading op het chlooratoom. Deze ladingsscheiding maakt waterstofchloride tot een polair molecuul.
Polaire moleculen zijn belangrijk omdat ze met elkaar kunnen communiceren via dipool-dipoolinteracties. Deze interacties worden veroorzaakt door de aantrekkingskracht tussen de positieve lading van het ene molecuul en de negatieve lading van een ander molecuul. Dipool-dipoolinteracties zijn verantwoordelijk voor veel van de eigenschappen van polaire moleculen, zoals hun hoge kookpunten en oplosbaarheid in water.
 Fysische eigenschappen van bariumsulfaat
Fysische eigenschappen van bariumsulfaat Elektrische schok tot koolstof maakt een betere waterzuiveraar
Elektrische schok tot koolstof maakt een betere waterzuiveraar Evaluatie van nieuwe verwerkingsplatforms voor farmaceutische productie
Evaluatie van nieuwe verwerkingsplatforms voor farmaceutische productie Creativiteit bij onderzoekers stimuleren:hoe automatisering een revolutie teweeg kan brengen in materiaalonderzoek
Creativiteit bij onderzoekers stimuleren:hoe automatisering een revolutie teweeg kan brengen in materiaalonderzoek Hoe uraniumwinning werkt
Hoe uraniumwinning werkt
Hoofdlijnen
- Hoe drie hardnekkige riffen kunnen helpen de mondiale oesterpopulaties te herstellen
- Welk probleem zouden mensen hebben als ze geen fenylalaninehydroxylase gebruiken?
- Waarom het DNA op groot papier plakken?
- Welk bewijs heb je voor de oorsprong van leven uit levenloze materie?
- Wat is de Western Blot-test?
- Waarom moeten cellen delen?
- Beeldvorming met hoge resolutie geeft een ongeëvenaard beeld van hoe schimmels groeien
- Spelt of zachte tarwe? Hun diversiteit aan voedingscomponenten verhindert de identificatie welke soort gezonder is
- Hoe bacteriën een enzym bouwen dat klimaatveranderend lachgas vernietigt
- Helderdere flexibele elektroluminescente film door de oogstructuur van nachtdieren aan te nemen

- Biologisch afbreekbare kunststoffen uit palmolieafval

- Een periodiek systeem van moleculaire knopen
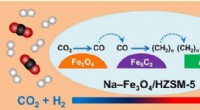
- Wetenschappers ontwikkelen efficiënte multifunctionele katalysator voor CO2-hydrogenering tot benzine
- Biologie, behoefte aan snelheid, tolereert een paar fouten

 Welke wetenschappelijke bijdrage heeft Lavoisier geleverd aan de chemie?
Welke wetenschappelijke bijdrage heeft Lavoisier geleverd aan de chemie?  Wat zijn mijnen?
Wat zijn mijnen?  Hoe spontane menselijke verbranding werkt
Hoe spontane menselijke verbranding werkt  Afvalwateroplossingen gericht op landbouw in Ghana
Afvalwateroplossingen gericht op landbouw in Ghana Ambidextere robots kunnen e-commerce drastisch versnellen
Ambidextere robots kunnen e-commerce drastisch versnellen Berekend door het massavolume te delen, hoe heet dit?
Berekend door het massavolume te delen, hoe heet dit?  Natuurkundigen benutten verwaarloosde eigenschappen van licht
Natuurkundigen benutten verwaarloosde eigenschappen van licht Onderzoek toont aan dat vrouwelijke managers geen hoger loon voor vrouwen bedoelen
Onderzoek toont aan dat vrouwelijke managers geen hoger loon voor vrouwen bedoelen
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

