
Wetenschap
Als de studenten 250 g calciumchloride zouden toevoegen aan een vriestemperatuur van 1000 graden water, zou deze oplossing hoogstwaarschijnlijk tussen de ?
Molaliteit (m) =mol opgeloste stof / kilogram oplosmiddel
Gegeven:
Massa calciumchloride (CaCl2) =250 g
Molaire massa van CaCl2 =110,98 g/mol
Volume water =1000 g (ervan uitgaande dat de dichtheid van water 1 g/ml is)
Converteer het watervolume naar kilogram:
Massa water =Volume × Dichtheid =1000 g × 1 g/ml =1000 g =1 kg
Bereken nu het aantal mol CaCl2:
Mol CaCl2 =massa / molaire massa =250 g / 110,98 g/mol ≈ 2,25 mol
Bereken ten slotte de molaliteit:
Molaliteit (m) =2,25 mol / 1 kg =2,25 mol/kg
De vriespuntsverlaging (ΔTf) van een oplossing is recht evenredig met de molaliteit van de oplossing en de vriespuntsverlagingsconstante (Kf) van het oplosmiddel. De vriespuntdalingsconstante van water (Kf) is 1,86 °C/mol/kg.
ΔTf =Kf × m =1,86 °C/mol/kg × 2,25 mol/kg ≈ 4,20 °C
Daarom zou het vriespunt van de oplossing ongeveer 4,20 °C lager zijn dan het vriespunt van zuiver water (0 °C). De vriestemperatuur van de oplossing zou dus hoogstwaarschijnlijk tussen -4,20 °C en 0 °C liggen.
 Azijn bestaat voor ongeveer 95 procent uit water en 5 procent uit azijnzuur. Welk type mengsel is dit?
Azijn bestaat voor ongeveer 95 procent uit water en 5 procent uit azijnzuur. Welk type mengsel is dit?  Hoeveel atomen zitten er in C6H4Cl2?
Hoeveel atomen zitten er in C6H4Cl2?  een eenvoudige woordvergelijking schrijven die laat zien dat je de lading van een ion kunt berekenen, gegeven de aantallen elektronen en protonen?
een eenvoudige woordvergelijking schrijven die laat zien dat je de lading van een ion kunt berekenen, gegeven de aantallen elektronen en protonen?  Onderzoek toont aan hoe kleine compartimenten aan cellen vooraf konden gaan
Onderzoek toont aan hoe kleine compartimenten aan cellen vooraf konden gaan Is calciumwaterstofcarbonaat een zuurbase of neutraal?
Is calciumwaterstofcarbonaat een zuurbase of neutraal?
Hoofdlijnen
- Een model van een plantencel in een plastic zak maken
- Hoe gezond is die pup op de website?
- Waarom vissen praten:communicatie met anemoonvissen vestigt status in sociale groepen (met video)
- Ontdekking van een potentieel therapeutisch doelwit om trypanosomen te bestrijden
- Dynamische beelden tonen ruitvormige protease in actie
- Wat verlaagt de pH-waarde bij mensen?
- Snelle diversificatie ondanks morfologische stilstand:een slakkengang op een plek?
- Een sleutelgen helpt verklaren hoe het vermogen om te zweven steeds opnieuw naar voren is gekomen tijdens de evolutie van het buideldier
- Hoe zou een nucleaire winter de voedselproductie beïnvloeden?
- Robotachtige zachte materie buigt, draait en kruipt wanneer geraakt met licht

- Video:Moet de Kerstman een vlamvertragend pak dragen?

- Elektrostatisch gecontroleerde oppervlakterandvoorwaarden in nematische vloeibare kristallen en colloïden

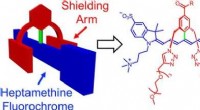
- Stabiele en functionele kleurstoffen voor nabij-infrarood fluorescentiebeeldvorming van levende onderwerpen
- In Australië worden zelfsteriliserende micronaalden ontwikkeld voor veiligere vaccinaties
 Hoe het NASA Space Food Research Lab werkt
Hoe het NASA Space Food Research Lab werkt  Wat versta je onder osmose?
Wat versta je onder osmose?  RNA-interferentie geleverd met behulp van nanodeeltjes treft doel bij menselijke patiënten
RNA-interferentie geleverd met behulp van nanodeeltjes treft doel bij menselijke patiënten Astronomen vinden het eerste sterrenstelsel waarvan de ultraviolette helderheid vergelijkbaar is met die van een quasar
Astronomen vinden het eerste sterrenstelsel waarvan de ultraviolette helderheid vergelijkbaar is met die van een quasar Superzware zwarte gaten kunnen zich tegoed doen aan één ster per jaar
Superzware zwarte gaten kunnen zich tegoed doen aan één ster per jaar Technologie om de veerkracht van bruggen te verbeteren
Technologie om de veerkracht van bruggen te verbeteren Grafeen geeft meer van zijn geheimen prijs
Grafeen geeft meer van zijn geheimen prijs Wintertarwe haalbaar dekgewas voor Rolling Plains-katoen
Wintertarwe haalbaar dekgewas voor Rolling Plains-katoen
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

