
Wetenschap
Wat is de elektronische geometrie van sulfiet?
Om de elektronische geometrie van een molecuul te bepalen, moeten we rekening houden met het aantal elektronenparen rond het centrale atoom. In het geval van sulfiet is het zwavelatoom het centrale atoom. Er zijn drie zuurstofatomen aan gebonden en één eenzaam elektronenpaar. Dit geeft een totaal van vier elektronenparen rond het zwavelatoom.
Volgens de VSEPR-theorie nemen vier elektronenparen rond een centraal atoom een tetraëdrische opstelling aan. In het geval van sulfiet is een van de elektronenparen echter een eenzaam paar. Alleenstaande paren nemen meer ruimte in beslag dan verbindende paren, waardoor de tetraëdrische opstelling wordt vervormd. Dit resulteert in een trigonale piramidale elektronische geometrie.
De moleculaire geometrie van sulfiet is ook trigonaal piramidaal. Dit komt omdat de moleculaire geometrie wordt bepaald door de rangschikking van de atomen, en de atomen zijn gerangschikt in een trigonale piramidevorm om de afstoting tussen de elektronenparen te minimaliseren.
 Wat zijn de voorbeelden van landbouw waarbij chemie helpt?
Wat zijn de voorbeelden van landbouw waarbij chemie helpt?  Bloed ruilen voor spuug om te helpen bij gemakkelijke gezondheidsmonitoring thuis
Bloed ruilen voor spuug om te helpen bij gemakkelijke gezondheidsmonitoring thuis  Wetenschappers hebben ontdekt hoe bloedwormen hun unieke koperen tanden maken
Wetenschappers hebben ontdekt hoe bloedwormen hun unieke koperen tanden maken Wat zijn alkalische en neutrale zuren?
Wat zijn alkalische en neutrale zuren?  Waarom is de ionische productconstante van water temperatuurafhankelijk?
Waarom is de ionische productconstante van water temperatuurafhankelijk?
 NASA kijkt naar tropische storm Pakhar in infrarood licht
NASA kijkt naar tropische storm Pakhar in infrarood licht Een groot deel van Oost-Antarctica is de afgelopen 8 miljoen jaar bevroren gebleven
Een groot deel van Oost-Antarctica is de afgelopen 8 miljoen jaar bevroren gebleven Heeft de mens de ineenstorting van het ecosysteem veroorzaakt in het oude Australië?
Heeft de mens de ineenstorting van het ecosysteem veroorzaakt in het oude Australië?  Australië belooft half miljard voor herstel Great Barrier Reef
Australië belooft half miljard voor herstel Great Barrier Reef Een verhaal van twee Delhi's:dodelijke lucht legt de kloof tussen rijken en armen bloot
Een verhaal van twee Delhi's:dodelijke lucht legt de kloof tussen rijken en armen bloot
Hoofdlijnen
- Hoe een agressieve schimmelziekte schimmel veroorzaakt in groenten en fruit
- Kleine opgerolde eiwitrollen die zichzelf in kooien assembleren
- Nieuw zenuwdegeneratiemolecuul geïdentificeerd
- Heeft die astroloog u goed gelezen? Dat is het Barnum-effect
- Nieuwe gegevens laten zien hoe staten het doen in de wetenschap
- Welke groepen mensen hebben de neiging hun IQ te overschatten?
- Wetenschappers ontdekken hoe mysterieus 'circulair RNA' wordt gevormd, claimen een verband met spierdystrofie
- Exploderende kamikazebacteriën:hoe een paar ‘soldaatcellen’ de bevolking virulentie verlenen door zichzelf op te offeren
- Wat hoorden dinosaurussen?
- Ontdekking van een universeel systeem voor het transporteren van nucleïnezuren in cellen
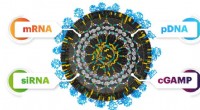
- Een snelle, gebruiksvriendelijke DNA-amplificatiemethode bij 37 Celsius

- Nieuw upcycling-systeem voor commerciële polyesters

- Melkeiwit kan de gezondheid van bosbessen helpen verbeteren

- Garnalenschelpen om elektroden te maken voor grote accu's

 Onderzoek maakt oplaadbare batterijen met een langere levensduur mogelijk
Onderzoek maakt oplaadbare batterijen met een langere levensduur mogelijk Wetenschappers rapporteren efficiënt gebruik van oud papier voor de productie van cellulase door Trichoderma longiflorum
Wetenschappers rapporteren efficiënt gebruik van oud papier voor de productie van cellulase door Trichoderma longiflorum Senior projectideeën voor elektronische engineering
Senior projectideeën voor elektronische engineering  De verschillen tussen bacteriën en algen
De verschillen tussen bacteriën en algen Goede en slechte effecten van fysisch-chemische verandering?
Goede en slechte effecten van fysisch-chemische verandering?  Onderzoekers helpen bij het ontwikkelen van duurzame polymeren
Onderzoekers helpen bij het ontwikkelen van duurzame polymeren Hoe maak je leuke zelfgemaakte Spider Traps
Hoe maak je leuke zelfgemaakte Spider Traps  Relatieve luchtdruk zoeken
Relatieve luchtdruk zoeken
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

