
Wetenschap
Wat zou de chemische verandering van aluminium zijn?
1. Oxidatie:Aluminium reageert gemakkelijk met zuurstof en vormt aluminiumoxide (Al2O3). Dit proces staat bekend als oxidatie en treedt op wanneer aluminium wordt blootgesteld aan lucht of water. De oxidelaag beschermt het metaal tegen verdere corrosie.
2. Reactie met zuren:Aluminium reageert met zuren om waterstofgas en een aluminiumzout te produceren. Wanneer aluminium bijvoorbeeld in zoutzuur (HCl) wordt geplaatst, reageert het onder vorming van aluminiumchloride (AlCl3) en waterstofgas (H2).
3. Reactie met alkaliën:Aluminium reageert met alkaliën en vormt een oplosbaar aluminaation (AlO2-). Wanneer aluminium bijvoorbeeld wordt toegevoegd aan natriumhydroxide (NaOH), reageert het onder vorming van natriumaluminaat (NaAlO2) en waterstofgas (H2).
4. Verbranding:Wanneer aluminium wordt verwarmd in aanwezigheid van zuurstof, ondergaat het een zeer exotherme reactie, waarbij een grote hoeveelheid warmte en licht vrijkomt. Dit proces staat bekend als verbranding en resulteert in de vorming van aluminiumoxide.
5. Reductie:Aluminium kan uit zijn verbindingen worden gereduceerd door reactievere metalen, zoals natrium of kalium. Wanneer aluminiumoxide bijvoorbeeld wordt verwarmd met natrium, ondergaat het een reductiereactie om aluminiummetaal en natriumoxide te vormen.
 Kleine fijne deeltjes met wereldwijde impact - radiokoolstof onthult de oorsprong van zwarte koolstof
Kleine fijne deeltjes met wereldwijde impact - radiokoolstof onthult de oorsprong van zwarte koolstof Als je tijdens de coronaviruspandemie groenten ging telen, ga dan zo door als de lockdown eindigt
Als je tijdens de coronaviruspandemie groenten ging telen, ga dan zo door als de lockdown eindigt Een lijst met landvormen in de tropische regio
Een lijst met landvormen in de tropische regio De toekomst zaaien? 'Ark' bewaart zeldzame, bedreigde planten
De toekomst zaaien? 'Ark' bewaart zeldzame, bedreigde planten  Nieuw model voor transportbandsysteem met diepe mantel in het hart van de aarde
Nieuw model voor transportbandsysteem met diepe mantel in het hart van de aarde
Hoofdlijnen
- Lichaamsmassa van bijen, ziekteverwekkers en lokale klimaatinvloeden hittetolerantie
- Welke groep genetische spieraandoeningen veroorzaakt progressieve zwakte en degeneratie van de skeletspieren zonder het zenuwstelsel aan te tasten?
- Bijenimiterende vliegen vertonen bestuiverpotentieel
- Er zijn nieuwe details onthuld over hoe planten een optimale sperma-ei-verhouding behouden
- Beren hebben geen last van een dieet met veel verzadigde vetten
- Neurobiologie:onderzoeken hoe vleermuizen verschillende geluiden onderscheiden
- Veranderingen in mariene ecosystemen blijven onopgemerkt
- Waarom walvissen geen hersenbeschadiging oplopen als ze zwemmen
- Wat zijn Agar Slants?
- Nieuwe fluoroforen kunnen kanker helpen bestrijden

- Superaerofobe hydrogels voor verbeterde elektrochemische en foto-elektrochemische waterstofproductie
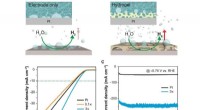
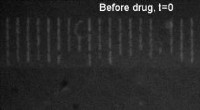
- Nieuwe techniek waarbij medicijnen bacteriën laten gloeien, kan antibioticaresistentie helpen bestrijden
- Giftig chroom uit water filteren

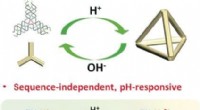
- Universele pH-gereguleerde assemblage van DNA-nanostructuren
 Grafeensensor spoort biomarkers voor kanker op
Grafeensensor spoort biomarkers voor kanker op Voordelen van gedigitaliseerd DNA delen
Voordelen van gedigitaliseerd DNA delen VK zou tegen 2050 CO2-neutraal kunnen zijn, zegt ambitieus nieuw rapport
VK zou tegen 2050 CO2-neutraal kunnen zijn, zegt ambitieus nieuw rapport Lunavity-apparaat waarmee de drager de zwaartekracht kan trotseren
Lunavity-apparaat waarmee de drager de zwaartekracht kan trotseren Hoe nucleaire detectives werken
Hoe nucleaire detectives werken  Hoe NAIRU berekenen
Hoe NAIRU berekenen  Hoe geometrische vormen te tekenen
Hoe geometrische vormen te tekenen Broeikasgassen waren in het verre verleden de belangrijkste aanjager van klimaatverandering
Broeikasgassen waren in het verre verleden de belangrijkste aanjager van klimaatverandering
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

