
Wetenschap
Wat gebeurt er als het element fosfor zijn ion vormt?
De elektronenconfiguratie van neutraal fosfor (P) is:
2, 8, 5
Wanneer fosfor drie valentie-elektronen verliest, wordt de elektronenconfiguratie:
2, 8, 2
Deze configuratie is stabieler omdat deze een gevuld extern energieniveau heeft, vergelijkbaar met dat van het edelgas neon (Ne). Door deze stabiele configuratie te bereiken krijgt het fosforion een positieve lading van +3, waardoor het een driewaardig kation wordt (P 3+ ).
De vorming van P 3+ ionen kunnen ontstaan wanneer fosforatomen reageren met sterk elektronegatieve elementen of groepen die een sterke neiging hebben om elektronen aan te trekken. Wanneer fosfor bijvoorbeeld reageert met zuurstof in de lucht, ondergaat het oxidatie, waarbij elektronen verloren gaan aan zuurstofatomen en de ionische verbinding fosforpentoxide (P2) wordt gevormd. O5 ). In deze verbinding bestaan fosforatomen als P 5+ ionen, wat aangeeft dat elk fosforatoom vijf valentie-elektronen heeft verloren.
Fosfor kan ook lagere oxidatietoestanden vormen, zoals het fosfietion (PO3 3- ) en het hypofosfiet-ion (PO2 3- ), waar het oxidatietoestanden van respectievelijk +3 en +1 heeft. Echter, de P 3+ ion is de meest voorkomende en stabiele vorm van fosfor in ionische verbindingen.
 Onderzoekers ontdekken een nieuwe gunstige functie van een oud eiwit
Onderzoekers ontdekken een nieuwe gunstige functie van een oud eiwit Waarom wordt waterstofgas niet gebruikt in ballonnen?
Waarom wordt waterstofgas niet gebruikt in ballonnen?  Chemici gebruiken supercomputers om oplosmiddelen te begrijpen
Chemici gebruiken supercomputers om oplosmiddelen te begrijpen Hoe een model van een calciumatom te bouwen
Hoe een model van een calciumatom te bouwen  Onderzoekers verwerven gelaagde metaalhalogenide-ferro-elektriciteit met hoge Curie-temperatuur via kooi-begrensde ethylaminerotators
Onderzoekers verwerven gelaagde metaalhalogenide-ferro-elektriciteit met hoge Curie-temperatuur via kooi-begrensde ethylaminerotators
 Koraalskeletten kunnen de effecten van verzurende oceanen weerstaan
Koraalskeletten kunnen de effecten van verzurende oceanen weerstaan Eekhoorns laten zich van hun zachtere kant zien door weeskinderen te adopteren, zo blijkt uit onderzoek
Eekhoorns laten zich van hun zachtere kant zien door weeskinderen te adopteren, zo blijkt uit onderzoek  Arctische open water perioden zullen naar verwachting dramatisch verlengen tegen 2100
Arctische open water perioden zullen naar verwachting dramatisch verlengen tegen 2100 Onderzoek toont aan dat ijskappen zo groot als Groenland snel smolten in een opwarmend klimaat
Onderzoek toont aan dat ijskappen zo groot als Groenland snel smolten in een opwarmend klimaat Kan een kunstmatig koraalrif de mariene biodiversiteit beschermen tegen klimaatveranderingen?
Kan een kunstmatig koraalrif de mariene biodiversiteit beschermen tegen klimaatveranderingen?
Hoofdlijnen
- Onderzoek onderzoekt hoe beslissingen over embryonale ontwikkeling tegelijkertijd via meerdere routes worden bestuurd
- Hoe zenuwcellen in vorm blijven
- Mannelijke spinnen laten zich van hun gevoelige kant zien
- Denken dieren rationeel? Onderzoeker suggereert dat voor rationele besluitvorming geen taal nodig is
- Wat betekent generatietijd in de microbiologie?
- Dankzij een krachtige nieuwe techniek kunnen wetenschappers bestuderen hoe eiwitten in cellen van vorm veranderen
- Enorme DNA-levensboom voor planten onthuld door een mondiaal wetenschappelijk team met behulp van 1,8 miljard letters genetische code
- Waar en waarom mensen schaatsen maakten van dierlijke botten
- Motoreiwitten vervoeren kostbare lading in neuronen. Hoe kunnen we hun beweging controleren?
- Aluminium op weg naar titaniumsterkte

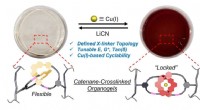
- Geen trial-and-error meer bij het kiezen van een elektrolyt voor metaal-luchtbatterijen
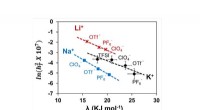
- In elkaar grijpende ringen ontgrendelen nieuwe materiaaleigenschappen
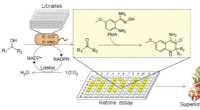
- Nieuwe high-throughput screeningmethode ontwikkeld voor ketonen
- Micro-dispenser voor langdurige opslag en gecontroleerde afgifte van vloeistoffen

 Kan cloudgebaseerde quantumcomputing echt een voordeel bieden?
Kan cloudgebaseerde quantumcomputing echt een voordeel bieden?  Twitter gaat gemanipuleerde inhoud, waaronder deepfakes, aan banden leggen
Twitter gaat gemanipuleerde inhoud, waaronder deepfakes, aan banden leggen Golden Gate Bridge-feiten voor uw volgende Trivia-avond
Golden Gate Bridge-feiten voor uw volgende Trivia-avond  Is Indy op jacht naar een nepperd?
Is Indy op jacht naar een nepperd?  Het effect van temperatuur op bellenoplossing
Het effect van temperatuur op bellenoplossing  Onderzoeksteam ontwikkelt hoogwaardige flexibele solid-state batterij
Onderzoeksteam ontwikkelt hoogwaardige flexibele solid-state batterij Hoe wordt de lading van een atoom of ion bepaald op basis van het aantal aanwezige protonen, neutronen en elektronen?
Hoe wordt de lading van een atoom of ion bepaald op basis van het aantal aanwezige protonen, neutronen en elektronen?  Onderzoeker weegt op feeënkringen van Namibië
Onderzoeker weegt op feeënkringen van Namibië
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

