
Wetenschap
Bereken hoeveel C- en O-atomen aanwezig zijn in 11,2 liter koolstofdioxide bij STP?
Volume kooldioxide =11,2 liter
Temperatuur (T) =273 K
Druk (P) =1 atm
Nu moeten we het aantal mol CO2 vinden dat aanwezig is in 11,2 liter,
PV=nRT
Waar P =druk,
V=volume,
N=aantal moedervlekken,
R=gasconstante, en
T=temperatuur
Door waarden te plaatsen, krijgen we
$$\Pijl naar rechts 1\maal 11,2=n\maal 0,0821\maal 273$$
$$\Pijl naar rechts n=\frac{11,2}{22,4}=0,5mol$$
Er is 0,5 mol kooldioxide aanwezig in 11,2 liter bij STP.
Omdat 1 mol koolstofdioxide 1 mol koolstofatomen en 2 mol zuurstofatomen bevat.
Dus 0,5 mol koolstofdioxide bevat 0,5 mol koolstofatomen en 1 mol zuurstofatomen.
Daarom is het aantal koolstofatomen in 11,2 liter koolstofdioxide bij STP
$$=0,5\maal 6,023\maal 10^{23}$$
$$=3,0115\maal 10^{23}$$
Het aantal zuurstofatomen in 11,2 liter kooldioxide bij STP
$$=1\maal 6,023\maal 10^{23}$$
$$=6,023\maal 10^{23}$$
 De verschillen tussen HPLC en GC
De verschillen tussen HPLC en GC Ontwikkeling van cellulaire membraan-FET (lipid-FET) voor gevoeligheid van biosensor
Ontwikkeling van cellulaire membraan-FET (lipid-FET) voor gevoeligheid van biosensor Wat is de uitgebalanceerde symboolvergelijking voor kalium en zuurstof?
Wat is de uitgebalanceerde symboolvergelijking voor kalium en zuurstof?  Ingenieurs creëren een inhaleerbare vorm van boodschapper-RNA
Ingenieurs creëren een inhaleerbare vorm van boodschapper-RNA Serendipiteitsexperiment in de achtertuin werpt licht op de productie van polymeren
Serendipiteitsexperiment in de achtertuin werpt licht op de productie van polymeren
 Nutriëntentekorten in rijst geteeld onder hogere kooldioxide kunnen gezondheidsrisico's voor tientallen miljoenen verhogen
Nutriëntentekorten in rijst geteeld onder hogere kooldioxide kunnen gezondheidsrisico's voor tientallen miljoenen verhogen Is hennep de sleutel tot een duurzame toekomst?
Is hennep de sleutel tot een duurzame toekomst?  Onderzoek naar permafrost kusterosie in het noordpoolgebied
Onderzoek naar permafrost kusterosie in het noordpoolgebied Onweersastma - pollen tellen om levens te redden
Onweersastma - pollen tellen om levens te redden Erosiesnelheden bepalen via schilderen
Erosiesnelheden bepalen via schilderen
Hoofdlijnen
- Waarom heeft een regenworm een gesloten bloedsomloop?
- Wat chimpansees ons kunnen leren over economie
- Wat is de definitie van reproductief vermogen?
- Invasieve kikkers geven invasieve vogels een boost op Hawaï
- Dawn of fishes:vroeg-silurische kaken van gewervelde dieren van kop tot staart onthuld
- De wetenschap achter waarom sommige mensen van dieren houden en anderen niets kan schelen
- Nieuwe techniek kan verband aantonen tussen prooidieren en microplastics
- Passagiersduivengenoom toont effecten van natuurlijke selectie in een enorme populatie
- Zou u op een Democraat stemmen die zich als Republikein gedraagt?
- Slimme materialen van de volgende generatie bouwen met de kracht van geluid

- Onderzoekers lossen een wetenschappelijk mysterie over verdamping op

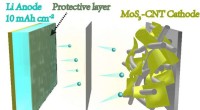
- Het wegnemen van de knelpunten in de prestaties van lithium-zwavelbatterijen

- Chemici vinden nieuwe manier om lithiummetaalelektroden voor batterijen te maken
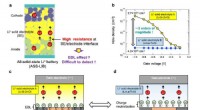
- Nieuwe manier om het elektrische dubbellaagse effect te onderzoeken
 Reality check voor topologische isolatoren
Reality check voor topologische isolatoren Nieuw onderzoek voorspelt nauwkeurig de Australische tarweoogst maanden voor de oogst
Nieuw onderzoek voorspelt nauwkeurig de Australische tarweoogst maanden voor de oogst Pandemie biedt pauze, niet eindigen, naar globalisering
Pandemie biedt pauze, niet eindigen, naar globalisering Waarom is water bij stp een vloeistof, terwijl koolstofdioxidegas?
Waarom is water bij stp een vloeistof, terwijl koolstofdioxidegas?  Wetenschappers vinden een manier om te kwantificeren hoe goed de allernieuwste microscopietechniek werkt
Wetenschappers vinden een manier om te kwantificeren hoe goed de allernieuwste microscopietechniek werkt  James Clerk Maxwell Telescope ontdekt flare 10 miljard keer krachtiger dan die op de zon
James Clerk Maxwell Telescope ontdekt flare 10 miljard keer krachtiger dan die op de zon Controle van celpopulatiegroottes:wanneer is genoeg genoeg?
Controle van celpopulatiegroottes:wanneer is genoeg genoeg?  Peiling:leerachterstanden een grote zorg voor ouders
Peiling:leerachterstanden een grote zorg voor ouders
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

