
Wetenschap
Als 3,21 mol gas 56,2 liter in beslag neemt bij 44 C en 793 torr 5,29 liter, neemt dit dan in beslag?
```
PV =nRT
```
Waar:
* P is de druk in atmosfeer
* V is het volume in liters
* n is het aantal mol gas
* R is de ideale gasconstante (0,08206 L * atm / mol * K)
* T is de temperatuur in Kelvin
We krijgen de volgende informatie:
* n =3,21 mol
* V =56,2 liter
* T =44 °C + 273,15 =317,15 K
* P =793 torr * (1 atm / 760 torr) =1,043 atm
We kunnen de ideale gaswet herschikken om V op te lossen:
```
V =nRT / P
```
Als we onze waarden vervangen, krijgen we:
```
V =(3,21 mol * 0,08206 L * atm / mol * K * 317,15 K) / 1,043 atm
```
```
V =84,5 L
```
Daarom neemt het gas onder de gegeven omstandigheden 84,5 liter in beslag.
 NASA ziet tropische cycloon Veronica de Australische Pilbara-kust treffen
NASA ziet tropische cycloon Veronica de Australische Pilbara-kust treffen Aandacht voor de hitte:woestijngebieden kunnen de toekomst van mondiale gematigde zones als gevolg van klimaatverandering beter informeren
Aandacht voor de hitte:woestijngebieden kunnen de toekomst van mondiale gematigde zones als gevolg van klimaatverandering beter informeren Het effect van klimaatverandering op gewasopbrengsten voorspellen
Het effect van klimaatverandering op gewasopbrengsten voorspellen Rapport:Europese zwemwaterkwaliteit blijft hoog
Rapport:Europese zwemwaterkwaliteit blijft hoog Afbeelding:branden in het zuidoosten van de Verenigde Staten, zowel wild als voorgeschreven
Afbeelding:branden in het zuidoosten van de Verenigde Staten, zowel wild als voorgeschreven
Hoofdlijnen
- Onderzoek toont aan hoe neuronen hun eindbestemming bereiken
- Speekseleiwitten kunnen verklaren waarom sommige mensen te veel zout gebruiken
- Onderzoek naar vogelluis laat zien hoe de evolutie zich soms herhaalt
- Het belang van diffusie in organismen
- Wat maakte de mens tot ‘de dikke primaat’?
- Wetenschappers die onderzoek doen naar RNA-bewerking belichten mogelijke levensreddende behandelingen voor genetische ziekten
- Ecologen zeggen dat het metabolisme de oorzaak is van het feit dat natuurlijke selectie slechts bepaalde soorten bevoordeelt
- Hoe de kleine verandering van een eiwit tot grote problemen voor cellen leidt
- Vermijd sommige hondenoogdoekjes van Project Watson vanwege infectiegevaar, waarschuwt de consumentencommissie
- Nieuwe röntgenmethode heeft ingrijpende gevolgen voor de ontwikkeling van levensreddende medicijnen
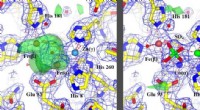
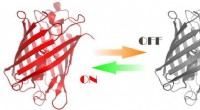
- Wetenschappers hebben eiwitten gemaakt die worden gecontroleerd door licht
- Chemici slagen erin aminoalcoholen te synthetiseren door gebruik te maken van licht
- Het membraan in membraanloze organellen begrijpen
- Utrechtse chemici bewijzen Nobelprijswinnaar Olah gelijk
 Gebouwen verwarmen:de over het hoofd geziene klimaatveranderingsfactor
Gebouwen verwarmen:de over het hoofd geziene klimaatveranderingsfactor Welk voedselmolecuul kan worden afgebroken om organismen van energie te voorzien?
Welk voedselmolecuul kan worden afgebroken om organismen van energie te voorzien?  Waarom blazen ballonnen op in een fles heet water?
Waarom blazen ballonnen op in een fles heet water?  Onderzoekers controleren meerdere golflengten van licht uit één enkele bron
Onderzoekers controleren meerdere golflengten van licht uit één enkele bron Rivier-grondwater hotspot voor arseen
Rivier-grondwater hotspot voor arseen Zijn toekomstige daden belangrijker dan daden uit het verleden? Het hangt af van tijd en cultuur
Zijn toekomstige daden belangrijker dan daden uit het verleden? Het hangt af van tijd en cultuur  Moleculaire fontein leidt tot een nauwkeurigere meting van fysische constanten
Moleculaire fontein leidt tot een nauwkeurigere meting van fysische constanten Geuren detecteren aan de rand:Onderzoekers ontcijferen hoe insecten meer ruiken met minder
Geuren detecteren aan de rand:Onderzoekers ontcijferen hoe insecten meer ruiken met minder
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

