
Wetenschap
Hoeveel elektronen zouden er nodig zijn om 6,35 gram koper aan de kathode af te zetten tijdens de elektrolyse van een waterige oplossing van sulfaat?
De wet van Faraday stelt dat de hoeveelheid stof die tijdens elektrolyse op een elektrode wordt afgezet, recht evenredig is met de hoeveelheid lading die door de elektrode gaat. De hoeveelheid lading wordt bepaald door het aantal overgedragen elektronen.
De formule voor de wet van Faraday is:
$$m =\frac{MIt}{nF}$$
waar:
- m is de massa van de afgezette substantie (in grammen)
- M is de molaire massa van de stof (in gram per mol)
- I is de stroomsterkte (in ampère)
- t is de tijd (in seconden)
- n is het aantal overgedragen elektronen per atoom of molecuul van de stof
- F is de constante van Faraday (96.485 coulomb per mol)
In het geval van koper is de molaire massa 63,55 gram per mol en heeft elk koperatoom twee elektronen nodig om te worden afgezet.
Als we de gegeven waarden in de formule vervangen, krijgen we:
$$6,35 g =\frac{63,55 g/mol \times I \times t}{2mol \times 96.485 C/mol}$$
Als we I oplossen, krijgen we:
$$I =\frac{6,35 g \times 2 mol \times 96.485 C/mol}{63,55 g/mol \times t}$$
Deze vergelijking geeft ons de stroom die nodig is om 6,35 gram koper in een bepaalde tijd af te zetten. Het aantal benodigde elektronen kan worden berekend door de stroom te vermenigvuldigen met de tijd en te delen door de constante van Faraday:
$$n =\frac{I \times t}{F}$$
Als we de berekende waarde van I vervangen, krijgen we:
$$n =\frac{(6,35 g \maal 2 mol \maal 96.485 C/mol)/(63,55 g/mol \maal t) \maal t}{96.485 C/mol}$$
Vereenvoudigend krijgen we:
$$n =\frac{6,35 g \times 2 mol}{63,55 g/mol}$$
$$n =0,2 mol$$
Daarom zouden er 0,2 mol elektronen nodig zijn om 6,35 gram koper aan de kathode af te zetten tijdens de elektrolyse van een waterige oplossing van kopersulfaat.
 Effecten van ozonafbraak gevoeld in de tropen
Effecten van ozonafbraak gevoeld in de tropen EPA-chef gaat privé ontmoeten met leidinggevenden in de chemische industrie
EPA-chef gaat privé ontmoeten met leidinggevenden in de chemische industrie Het natuurbehoudsmodel van Zuid-Afrika:waarom het uitbreiden van het gebruik van biodiversiteit om geld te genereren een goed idee is
Het natuurbehoudsmodel van Zuid-Afrika:waarom het uitbreiden van het gebruik van biodiversiteit om geld te genereren een goed idee is  Veerkracht, niet ineenstorting:wat de Paaseiland-mythe verkeerd doet
Veerkracht, niet ineenstorting:wat de Paaseiland-mythe verkeerd doet  Nieuw boek laat zien hoe het oude Griekse schrift ons helpt de huidige milieucrises te begrijpen
Nieuw boek laat zien hoe het oude Griekse schrift ons helpt de huidige milieucrises te begrijpen
Hoofdlijnen
- Zijn koralen genetisch uitgerust om de klimaatverandering te overleven?
- Waarom onze voorouders gendergelijker waren dan wij
- Onderzoek werpt nieuw licht op hoe bodemvirussen zich gedragen en interageren met bacteriën
- Indringende vraag:Waarom worden albino's altijd als schurken neergezet?
- Nieuw onderzoek laat zien hoe mobiel DNA overleeft – en gedijt in planten en dieren
- Laat mijn brein me dingen kopen die ik niet nodig heb?
- Doen eukaryote cellen door binaire fissie?
- Hoe een dodelijke schimmel het immuunsysteem ontwijkt
- Onderzoeksteam ontwikkelt universele en nauwkeurige methode om te berekenen hoe eiwitten interageren met medicijnen
- Een kleurrijke detector

- Een puzzel strijken

- Ingenieurs ontwikkelen slim materiaal dat van stijfheid verandert wanneer het wordt gedraaid of gebogen

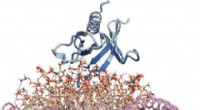
- Inzichten op atoomniveau verkregen voor een belangrijk lipidenbindend eiwit dat betrokken is bij kanker
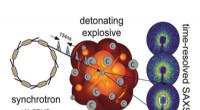
- Eerste Amerikaanse experimenten ooit in nieuwe röntgenfaciliteit kunnen leiden tot betere modellering van explosieven
 Hoe de snelheid van een elektron te berekenen
Hoe de snelheid van een elektron te berekenen Nanowalls voor smartphones
Nanowalls voor smartphones Nieuw inzicht in hoeveel atmosfeer Mars verloor
Nieuw inzicht in hoeveel atmosfeer Mars verloor Onderzoekers observeren dwarse wiebelbanden in neodymium-136
Onderzoekers observeren dwarse wiebelbanden in neodymium-136 Nieuw onderzoek identificeert de sterke en zwakke punten van supermateriaal
Nieuw onderzoek identificeert de sterke en zwakke punten van supermateriaal Wetenschappers observeren superzwaar zwart gat in het universum van baby's
Wetenschappers observeren superzwaar zwart gat in het universum van baby's Huawei verdedigt wereldwijde ambities te midden van westerse veiligheidsangsten
Huawei verdedigt wereldwijde ambities te midden van westerse veiligheidsangsten Vooruitgang in femtoseconde laser direct schrijven van Bragg-vezelroosters in multicore-vezels
Vooruitgang in femtoseconde laser direct schrijven van Bragg-vezelroosters in multicore-vezels
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

