
Wetenschap
Tussen welke soorten elementen vindt covelente binding plaats?
Enkele voorbeelden van covalente bindingen zijn:
- Waterstof (H) en waterstof (H)
- Koolstof (C) en koolstof (C)
- Stikstof (N) en stikstof (N)
- Zuurstof (O) en zuurstof (O)
- Fluor (F) en fluor (F)
Covalente bindingen kunnen ook optreden tussen twee verschillende niet-metalen elementen. Enkele voorbeelden zijn:
- Waterstof (H) en chloor (Cl)
- Koolstof (C) en zuurstof (O)
- Stikstof (N) en waterstof (H)
- Zuurstof (O) en waterstof (H)
- Fluor (F) en waterstof (H)
Over het algemeen zijn covalente bindingen sterker dan ionische bindingen. Dit komt omdat de elektronen in een covalente binding worden gedeeld tussen de twee atomen, terwijl de elektronen in een ionische binding worden overgedragen van het ene atoom naar het andere.
 Hoe Concordes werken
Hoe Concordes werken  Hoe statische elektriciteit te produceren
Hoe statische elektriciteit te produceren Hoe goed giftige elementen uit steenkoolas lekken, hangt af van de samenstelling van de as op nanoschaal, blijkt uit onderzoek
Hoe goed giftige elementen uit steenkoolas lekken, hangt af van de samenstelling van de as op nanoschaal, blijkt uit onderzoek  Een potentieel goedkope, efficiënt en milieuvriendelijk systeem voor het zuiveren van aardgas
Een potentieel goedkope, efficiënt en milieuvriendelijk systeem voor het zuiveren van aardgas Wetenschappers creëren chemische tuinen die kunnen worden gebruikt als botvervangende materialen
Wetenschappers creëren chemische tuinen die kunnen worden gebruikt als botvervangende materialen
 Hoe het SuperNEMO-experiment het mysterie van de oorsprong van materie in het universum zou kunnen helpen oplossen
Hoe het SuperNEMO-experiment het mysterie van de oorsprong van materie in het universum zou kunnen helpen oplossen  Canada's landbouwgrond is een verstandige investering - tijdens en na het coronavirus
Canada's landbouwgrond is een verstandige investering - tijdens en na het coronavirus Wat zijn de voordelen van biologisch afbreekbaar plastic?
Wat zijn de voordelen van biologisch afbreekbaar plastic?  Wetenschappers weten nog steeds niet hoe ver het smelten op Antarctica zal gaan, of de zeespiegelstijging zal het ontketenen
Wetenschappers weten nog steeds niet hoe ver het smelten op Antarctica zal gaan, of de zeespiegelstijging zal het ontketenen Wijdverbreid risico op grondwaterverontreiniging door chroom
Wijdverbreid risico op grondwaterverontreiniging door chroom
Hoofdlijnen
- Nieuwe aanpak breidt de kwantificering van de uitwisseling van voedingsstoffen in plantenweefsels, de rhizosfeer en de bodem uit
- Een DNA-model maken met piepschuimballen
- Wie houdt er van keverspiesjes? Wat Europeanen denken over alternatief eiwitrijk voedsel
- De evolutie van taal? Daar is een app voor
- Kunnen wetenschappers genbewerking gebruiken voor ziektepreventie, maar niet voor menselijke verbetering?
- Is dat een teelbal of een iriserende streep? De mannelijke ware kleuren van een vrouwelijke inktvis
- Hoe invasieve regenwormen ecosystemen schaden
- Hoe cellen condensatie gebruiken om weefsels goed af te dichten
- Eerste luxe Perigord-truffel wordt in Groot-Brittannië verbouwd
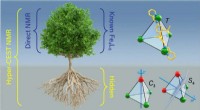
- Hyper-CEST NMR-techniek onthult ontbrekende structuur van een nieuw containermolecuul
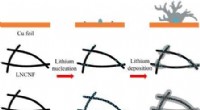
- Een lichtgewicht op koolstof nanovezel gebaseerde collector
- Ontwikkeling van een nieuw, goedkoop apparaat voor de productie van galliumnitride (GaN) kristallen

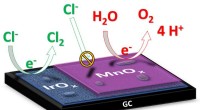
- Een stap dichter bij duurzame energie uit zeewater
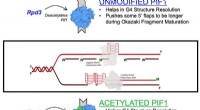
- Kankergebonden enzymmechanisme nieuw gekarakteriseerd in studie
 Minstens 16 gewonden bij vulkaanuitbarsting nabij skigebied Japan
Minstens 16 gewonden bij vulkaanuitbarsting nabij skigebied Japan Nieuw systeem belooft een snellere en nauwkeurigere voorspelling van regenval
Nieuw systeem belooft een snellere en nauwkeurigere voorspelling van regenval De natuur kan helpen bij het oplossen van optimalisatieproblemen
De natuur kan helpen bij het oplossen van optimalisatieproblemen Wat is de ecologische voetafdruk van het bezitten van vis als huisdier? Een deskundige legt het uit
Wat is de ecologische voetafdruk van het bezitten van vis als huisdier? Een deskundige legt het uit  Eerste Europese kaart van de isolerende werking van bossen
Eerste Europese kaart van de isolerende werking van bossen Dieetverandering – een oplossing om het waterverbruik te verminderen?
Dieetverandering – een oplossing om het waterverbruik te verminderen?  Hoe een vluchttijd voor een projectiel op te lossen
Hoe een vluchttijd voor een projectiel op te lossen Onderzoekers werpen licht op hoe fotopolymerisatie veel efficiënter kan worden gemaakt
Onderzoekers werpen licht op hoe fotopolymerisatie veel efficiënter kan worden gemaakt
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

