
Wetenschap
Wat maakt een vaste stof anders dan een vloeistof?
1. Definitieve vorm en volume: Vaste stoffen hebben een bepaalde vorm en volume. Hun deeltjes zijn stevig op elkaar gepakt en sterk gebonden, waardoor ze een stijve structuur vormen die bestand is tegen veranderingen in vorm of volume. Vloeistoffen nemen daarentegen de vorm aan van de container waarin ze zich bevinden en hebben een bepaald volume maar geen bepaalde vorm. Hun deeltjes zijn minder dicht op elkaar gepakt en kunnen vrijer bewegen, waardoor vloeistoffen kunnen stromen en zich kunnen aanpassen aan de vorm van hun container.
2. Intermoleculaire krachten: De sterkte van de intermoleculaire krachten tussen deeltjes is een cruciale factor die vaste stoffen van vloeistoffen onderscheidt. In vaste stoffen worden de deeltjes bij elkaar gehouden door sterke intermoleculaire krachten zoals covalente bindingen, ionische bindingen of metaalbindingen. Deze krachten houden de deeltjes op hun plaats, wat resulteert in een stijve structuur. In vloeistoffen zijn de intermoleculaire krachten zwakker, zoals van der Waals-krachten of waterstofbruggen. Deze zwakkere krachten zorgen ervoor dat de deeltjes vrijer kunnen bewegen, waardoor vloeistoffen vloeibaarder worden.
3. Deeltjesrangschikking: De rangschikking van deeltjes in vaste stoffen en vloeistoffen verschilt aanzienlijk. In vaste stoffen zijn deeltjes gerangschikt in een regelmatig, geordend patroon, waarbij ze vaak een kristallijne structuur vormen. De deeltjes in vloeistoffen zijn daarentegen willekeurig gerangschikt en hebben geen vast patroon. Dit verschil in deeltjesrangschikking draagt bij aan de verschillende eigenschappen van vaste stoffen en vloeistoffen.
4. Dichtheid: Vaste stoffen zijn over het algemeen dichter dan vloeistoffen. Dichtheid wordt gedefinieerd als de massa per volume-eenheid. In vaste stoffen nemen de dicht opeengepakte deeltjes een kleiner volume in, wat resulteert in een hogere dichtheid. Vloeistoffen hebben, met hun minder dicht opeengepakte deeltjes, een lagere dichtheid vergeleken met de meeste vaste stoffen.
5. Samendrukbaarheid: Vaste stoffen zijn minder samendrukbaar dan vloeistoffen. Samendrukbaarheid verwijst naar het vermogen van een stof om zijn volume te verkleinen wanneer er druk op wordt uitgeoefend. Vaste stoffen hebben sterke intermoleculaire krachten die compressie weerstaan, waardoor ze moeilijk samen te drukken zijn. Vloeistoffen zijn, met hun zwakkere intermoleculaire krachten, beter samendrukbaar en kunnen gemakkelijk worden samengedrukt als er druk op wordt uitgeoefend.
6. Verspreiding: Diffusie is de beweging van deeltjes van een gebied met een hogere concentratie naar een gebied met een lagere concentratie. In vaste stoffen beperken de sterke intermoleculaire krachten de beweging van deeltjes, wat resulteert in een langzame diffusiesnelheid. Vloeistoffen hebben een hogere diffusiesnelheid vanwege de zwakkere intermoleculaire krachten en het vermogen van deeltjes om vrijer te bewegen.
7. Smelten en invriezen: Vaste stoffen kunnen door toepassing van warmte tot vloeistoffen worden gesmolten. Dit proces omvat het breken van de intermoleculaire krachten die de deeltjes bij elkaar houden. Omgekeerd kunnen vloeistoffen worden omgezet in vaste stoffen door warmte te verwijderen, waardoor de deeltjes kinetische energie verliezen en dichter op elkaar worden gepakt, wat leidt tot de vorming van een vaste structuur.
Het begrijpen van deze verschillen tussen vaste stoffen en vloeistoffen is cruciaal in verschillende wetenschappelijke disciplines en praktische toepassingen. Door intermoleculaire krachten en temperatuur te manipuleren, wordt het mogelijk om de eigenschappen van materialen voor gewenste doeleinden te controleren en te wijzigen.
 Doorlatende peptiden in de dunne darm vergemakkelijken de opname van het spijsverteringskanaal
Doorlatende peptiden in de dunne darm vergemakkelijken de opname van het spijsverteringskanaal Bionische idee stimuleert lithium-ion-extractie
Bionische idee stimuleert lithium-ion-extractie Internationaal team onderzoekt hoe selenium kan helpen in de strijd tegen eierstokkanker
Internationaal team onderzoekt hoe selenium kan helpen in de strijd tegen eierstokkanker  Wat definieert een exotgeïsche reactie?
Wat definieert een exotgeïsche reactie?  Uitzoeken of uw land olie heeft
Uitzoeken of uw land olie heeft
Hoofdlijnen
- Tandwortelpulp wordt een rijke bron van stamcellen
- Laboratoriumexperimenten met hoge resolutie laten zien hoe cellen 'eten'
- Waarom zou een verandering in de DNA-sequentie dat organisme veroorzaken?
- Wat maakt een allel dominant, recessief of mede-dominant?
- Grizzlies vertonen opmerkelijke gencontrole vóór en tijdens de winterslaap
- Studie werpt licht op hoe scramblase-eiwitten celmembranen herschikken
- Is kieming van zaad omkeerbaar of onomkeerbaar?
- Uitbreiding van Braziliaans suikerriet kan de wereldwijde CO2-uitstoot verminderen
- Antibiotica uit een moleculaire puntenslijper
- Ingenieurs maken slimme aerogel die lucht in drinkwater verandert

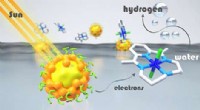
- Goedkoper, minder giftige en recyclebare lichtabsorbers voor waterstofproductie
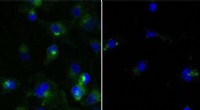
- Cellulaire opruiming kan ook vormen van kanker wegvagen
- Intense tests onthullen ongrijpbare, complexe vorm van gemeenschappelijk element

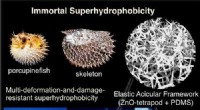
- Porcupinefish inspireert stevig superhydrofoob materiaal
 Wat zijn de zes ionen met dezelfde elektronenconfiguratie als Ne?
Wat zijn de zes ionen met dezelfde elektronenconfiguratie als Ne?  Hoe rotondes werken
Hoe rotondes werken  Astronomieteam vindt bewijs van galactisch metaal gehuld in stof
Astronomieteam vindt bewijs van galactisch metaal gehuld in stof Steenkool maken van voedselafval, tuinafval – en zelfs menselijk afvalwater
Steenkool maken van voedselafval, tuinafval – en zelfs menselijk afvalwater Chromatisch lichtdeeltjeseffect onthuld voor de ontwikkeling van fotonische kwantumnetwerken
Chromatisch lichtdeeltjeseffect onthuld voor de ontwikkeling van fotonische kwantumnetwerken Leren door ervaring in het virtuele tijdperk
Leren door ervaring in het virtuele tijdperk Gamma-ray binaire HESS J0632+057 bevat een pulsar, studie suggereert:
Gamma-ray binaire HESS J0632+057 bevat een pulsar, studie suggereert: Stompe nanostructuren kunnen hoogrenderende zonnecellen gemakkelijker te fabriceren maken
Stompe nanostructuren kunnen hoogrenderende zonnecellen gemakkelijker te fabriceren maken
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

