
Wetenschap
Waarom zijn elementen uit groep 17 sterke niet-metalen, terwijl 1-metalen?
Groep 1 metalen :Deze elementen bevinden zich aan de meest linkse kant van het periodiek systeem en staan bekend als alkalimetalen. Ze zijn zeer reactief en vormen monoatomaire ionen. Alkalimetalen hebben een lage elektronegativiteit, wat betekent dat ze een sterke neiging hebben om elektronen te verliezen. Dit maakt ze zeer reactief, omdat ze gemakkelijk hun buitenste elektron afstaan aan andere elementen.
Vergelijking :
- Elektronegativiteit :Groep 17-elementen hebben een hoge elektronegativiteit, terwijl Groep 1-metalen een lage elektronegativiteit hebben.
- Reactiviteit :Elementen uit Groep 17 zijn zeer reactief en vormen diatomische moleculen, terwijl elementen uit Groep 1 zeer reactief zijn en monoatomaire ionen vormen.
- Ionisatie-energie :Elementen uit Groep 17 hebben een hoge ionisatie-energie, terwijl elementen uit Groep 1 een lage ionisatie-energie hebben.
- Smelt- en kookpunten :Elementen uit Groep 17 hebben lage smelt- en kookpunten, terwijl metalen uit Groep 1 hoge smelt- en kookpunten hebben.
Samenvattend is de belangrijkste reden waarom elementen uit Groep 17 sterke niet-metalen zijn, terwijl metalen uit Groep 1 zeer reactieve metalen zijn, te wijten aan hun verschillen in elektronegativiteit.
 Klimaatverandering en verwaarlozing bedreigen Senegals Saint Louis
Klimaatverandering en verwaarlozing bedreigen Senegals Saint Louis Mauritius haast zich om olieramp in te dammen, kust beschermen
Mauritius haast zich om olieramp in te dammen, kust beschermen Nieuw onderzoek van Arctic:Ontdooiende permafrost-veengebieden kunnen bijdragen aan atmosferische CO2-belasting
Nieuw onderzoek van Arctic:Ontdooiende permafrost-veengebieden kunnen bijdragen aan atmosferische CO2-belasting Lijst met kleine bruine spinnen
Lijst met kleine bruine spinnen  Welke eigenschappen moet een oppervlak hebben als het licht dat erop reflecteert een helder beeld vormt?
Welke eigenschappen moet een oppervlak hebben als het licht dat erop reflecteert een helder beeld vormt?
Hoofdlijnen
- Welke organen deelt het skeletstelsel met andere systemen?
- Wat zijn enkele soorten bewijsmateriaal dat een forensisch botanicus verzamelt?
- Welke invloed had het uitsterven van sabeltandkatten op andere zoogdieren?
- Gedragsstudies tonen aan dat bavianen en duiven in staat zijn tot cognitie op een hoger niveau
- Onderzoekers ontwikkelen een algoritme om te bepalen hoe cellulaire ‘buurten’ in weefsels functioneren
- Platte gezichten en moeite met ademhalen:hoe huisdiertrends de diergezondheid hebben geschaad – en wat we eraan kunnen doen
- Hoe kan een fout tijdens de transcriptie het geproduceerde eiwit beïnvloeden?
- Wetenschappers ontdekken hoe parelmoer zichzelf assembleert tot een perfecte structuur
- Wat maakt rode algen zo anders en waarom zouden we ons daar zorgen over moeten maken?
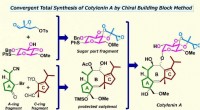
- Totale synthese van cotylenine A voor een nieuw geneesmiddel tegen kanker zonder bijwerkingen
- De nieuw ontdekte architectuur van een koper-nitrenoïde-complex kan een revolutie teweegbrengen in de chemische synthese

- Er zijn twee nodig:een katalysator met twee atomen, dat wil zeggen:zuurstof maken uit water
- Onderzoekers bestuderen aanwezigheid van gefluoreerde chemicaliën in brandweerkleding

- De opmerkelijke variabiliteit van elektronische structuren van actinidetetrafluoride

 Nieuwe aanpak kan halfgeleidertechnologie transformeren
Nieuwe aanpak kan halfgeleidertechnologie transformeren Uit onderzoek blijkt dat een derde van de huishoudens - dubbele eerdere schattingen - moeite heeft om aan voedsel te komen
Uit onderzoek blijkt dat een derde van de huishoudens - dubbele eerdere schattingen - moeite heeft om aan voedsel te komen Moleculaire zeef in de cel van eiwitkristal
Moleculaire zeef in de cel van eiwitkristal Hoe zwarte gaten werken
Hoe zwarte gaten werken  Vereiste chemische reacties om homeostase te handhaven
Vereiste chemische reacties om homeostase te handhaven Wat u moet weten over de eerste ruimtevlucht van Boeing met NASA-astronauten
Wat u moet weten over de eerste ruimtevlucht van Boeing met NASA-astronauten  Vraag en antwoord:Wat heeft wiskunde te maken met vrede?
Vraag en antwoord:Wat heeft wiskunde te maken met vrede? Kleine deeltjes, grote bevindingen:het maximaliseren van de energiewinst van kleine nanodeeltjes
Kleine deeltjes, grote bevindingen:het maximaliseren van de energiewinst van kleine nanodeeltjes
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

