
Wetenschap
Hoe seleniumverbindingen katalysatoren kunnen worden
1. Redoxreacties: Seleniumverbindingen kunnen deelnemen aan redoxreacties, waarbij ze oxidatie- en reductiecycli ondergaan. Dankzij dit vermogen kunnen ze elektronenoverdrachtsprocessen vergemakkelijken, die cruciaal zijn bij veel katalytische reacties. Seleniumdioxide (SeO2) kan bijvoorbeeld als oxidatiemiddel fungeren bij organische reacties, terwijl seleniden (Se2-) als reductiemiddel kunnen dienen.
2. Lewis zuur-base-katalyse: Seleniumverbindingen kunnen fungeren als Lewis-zuren of basen, waarbij ze respectievelijk elektronenparen doneren of accepteren. Deze eigenschap stelt hen in staat substraten te activeren en chemische transformaties te vergemakkelijken. Seleendioxide kan bijvoorbeeld werken als een Lewis-zuur, waardoor het zich coördineert met substraten en hun reactiviteit verbetert.
3. Organometaalkatalyse: Organoseleenverbindingen, die selenium-koolstofbindingen bevatten, kunnen complexen vormen met overgangsmetalen. Deze organometallische complexen kunnen katalytische activiteit vertonen bij verschillende reacties, zoals hydrogenerings-, hydroformylerings- en cycloadditiereacties. Het seleniumligand kan de reactiviteit en selectiviteit van het metaalcentrum beïnvloeden, wat leidt tot efficiënte katalytische processen.
4. Biokatalyse: Selenium is een essentieel sporenelement voor bepaalde enzymen, bekend als selenoproteïnen. Deze enzymen spelen een cruciale rol in verschillende biologische processen, waaronder de verdediging door antioxidanten, eiwitsynthese en metabolisme. Selenoproteïnen kunnen fungeren als katalysatoren bij enzymatische reacties, waardoor specifieke biochemische transformaties mogelijk worden gemaakt.
5. Fotokatalyse: Sommige seleniumverbindingen kunnen fungeren als fotokatalysatoren en chemische reacties op gang brengen bij blootstelling aan licht. Cadmiumselenide (CdSe) is bijvoorbeeld een halfgeleidermateriaal dat lichtenergie kan absorberen en elektronen-gatparen kan genereren. Deze ladingsdragers kunnen deelnemen aan redoxreacties, wat leidt tot de activering van substraten en daaropvolgende chemische transformaties.
Door deze katalytische eigenschappen te vertonen, vinden seleniumverbindingen toepassingen op verschillende gebieden, waaronder organische synthese, anorganische chemie, omgevingskatalyse en biotechnologie. Ze bieden unieke voordelen en reactiviteitspatronen, waardoor ze waardevolle hulpmiddelen zijn voor het bereiken van efficiënte en selectieve chemische processen.
 Is steenkool naar vloeistof efficiënter dan benzine?
Is steenkool naar vloeistof efficiënter dan benzine?  Ontwikkeling van betere fabricagetechnieken voor pH-responsieve microcapsules
Ontwikkeling van betere fabricagetechnieken voor pH-responsieve microcapsules Zachte water-nadelen
Zachte water-nadelen Licht gebruiken om medicijnen en plastics efficiënter te produceren
Licht gebruiken om medicijnen en plastics efficiënter te produceren  Nieuwe geleidende polymeerinkt opent voor de volgende generatie gedrukte elektronica
Nieuwe geleidende polymeerinkt opent voor de volgende generatie gedrukte elektronica
 Giftige planten in het regenwoud
Giftige planten in het regenwoud Verbeterd snoeien van bomen vermindert stormgerelateerde stroomuitval, studie vondsten
Verbeterd snoeien van bomen vermindert stormgerelateerde stroomuitval, studie vondsten Rapport:Klimaatvooruitzichten verbeteren naarmate er minder kolencentrales worden gebouwd
Rapport:Klimaatvooruitzichten verbeteren naarmate er minder kolencentrales worden gebouwd Facebook zegt hard op te treden tegen verkeerde informatie over klimaatverandering. Wetenschappers zeggen dat het niet genoeg doet.
Facebook zegt hard op te treden tegen verkeerde informatie over klimaatverandering. Wetenschappers zeggen dat het niet genoeg doet. Door aangetaste bodems zullen tropische bossen mogelijk nooit volledig herstellen van houtkap
Door aangetaste bodems zullen tropische bossen mogelijk nooit volledig herstellen van houtkap
Hoofdlijnen
- Hoe evolutie de geometrieën van het leven vormgeeft:wetenschappers lossen een al lang bestaande biologische puzzel op
- Kan biologische productie de drijvende kracht zijn achter de ontwikkeling in Afrika?
- Maakt Botox je gelukkiger als het je frons wegneemt?
- Is ooggrootte gerelateerd aan genetica of omgeving?
- Gliale cellen (Glia): definitie, functie, typen
- Hoe cellen in plantenbladeren zichzelf organiseren om een optimaal gebied voor fotosynthese te garanderen
- 3D-geprint voedsel kan de manier waarop we eten veranderen
- Sperma zijn, of niet sperma? Ontdekking van een genetische schakelaar die het lot van kiemcellen bepaalt
- Mysterie opgelost? Biologen vinden een unieke versie van filamentvormend eiwit in menselijke cellen die insecten niet hebben
- Onderzoekers maken superlijm op basis van slangengif die het bloeden binnen enkele seconden stopt met zichtbaar licht

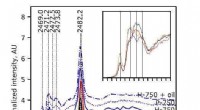
- Onderzoekers brengen moleculen in beeld terwijl ze voor het eerst van lading veranderen
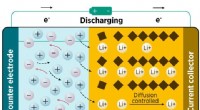
- Röntgenanalyse onthult het oplaadmechanisme van een veelbelovend elektrodemateriaal
- Ontwerpen van selectieve reacties om biologische processen te moduleren

- Hoe maakten de oude meesters hun ultramarijn?
 Tarotkaart Zeven van toverstokken Betekenis:je positie verdedigen en uitdagingen overwinnen
Tarotkaart Zeven van toverstokken Betekenis:je positie verdedigen en uitdagingen overwinnen  Bemanning ruimtestation moet Sojoez verhuizen, maak plaats voor nieuwe bemanningsleden
Bemanning ruimtestation moet Sojoez verhuizen, maak plaats voor nieuwe bemanningsleden Wetenschappers definiëren binaire tropische cyclonen
Wetenschappers definiëren binaire tropische cyclonen Onderzoekers ontwerpen zachte robots die zelfstandig kunnen bewegen
Onderzoekers ontwerpen zachte robots die zelfstandig kunnen bewegen Grootschalige walvisvangst in Noord-Scandinavië dateert mogelijk uit de 6e eeuw
Grootschalige walvisvangst in Noord-Scandinavië dateert mogelijk uit de 6e eeuw De wederopbouw van de Notre Dame duurt lang, beladen en duur
De wederopbouw van de Notre Dame duurt lang, beladen en duur NASA's Terra Satellite ziet het einde van Bavi
NASA's Terra Satellite ziet het einde van Bavi Bodemwetenschappers gebruiken mijnafval om door mensen veroorzaakte woestenij te herstellen
Bodemwetenschappers gebruiken mijnafval om door mensen veroorzaakte woestenij te herstellen
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

