
Wetenschap
Enzym voor biokatalyse gebruikt oplosmiddel als substraat
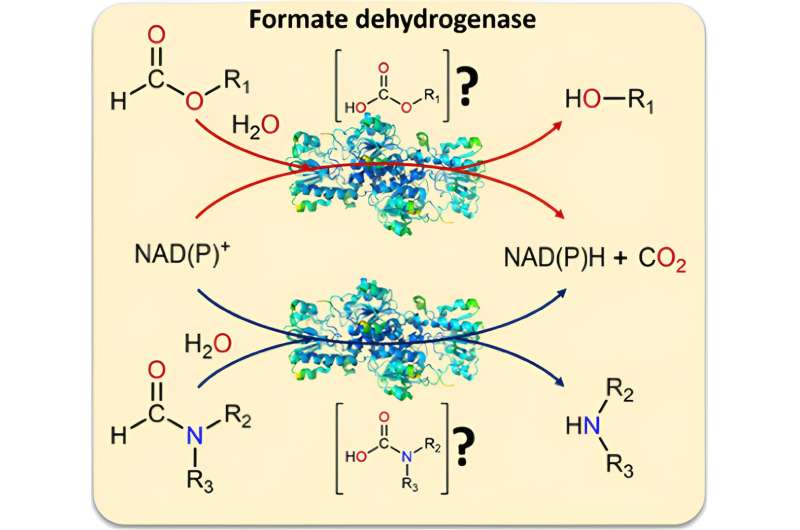
Een groot aantal toepassingen in de chemische industrie zijn afhankelijk van de moleculen NADH of NADPH als brandstof. Een team onder leiding van professor Dirk Tischler, hoofd van de werkgroep Microbiële Biotechnologie aan de Ruhr Universiteit Bochum, gebruikte een biokatalysator om hun productie in detail te bestuderen.
De onderzoekers bewezen dat de biokatalysator formiaat dehydrogenase naast formiaat ook formamiden kan omzetten. Dit betekent onder meer dat het enzym ook de moeilijk te verbreken C-N-binding kan splitsen. Daarnaast zijn formamiden een veelgebruikt oplosmiddel.
"Dit opent volledig nieuwe mogelijkheden voor slecht oplosbare NADH-reacties en voor NADPH-afhankelijke reacties", zegt Tischler.
De onderzoekers publiceerden hun bevindingen in het tijdschrift ACS Catalysis op 26 januari 2024.
Formaatdehydrogenase wordt gebruikt in biokatalytische processen om elektronen beschikbaar te maken als brandstof voor verdere reacties door ze uit een substraat te verwijderen. In de huidige toepassingen is het substraat NAD+ en het product NADH. Het afvalproduct is CO2 .
"Dit is in dit geval een goede zaak, omdat het als gas ontsnapt en daardoor voorkomt dat de gewenste reactie omgekeerd plaatsvindt", legt Tischler uit.
Omdat de NADPH-variant – met nog een fosfaatgroep – vaak nodig is als product, creëerde zijn team mutanten van de biokatalysator die NADP+ omzet in het gewenste product.

Wat als de katalysator ook de C-N-binding verbreekt?
Terwijl ze aan het formiaat dehydrogenase werkten, realiseerden de onderzoekers zich dat er weinig bekend was over alternatieve uitgangsmaterialen voor de biokatalysator. "We hebben naar verschillende mogelijke substraten (formiaatderivaten) gekeken en ontdekten dat een C-O-binding altijd wordt verbroken wanneer deze door de biokatalysator wordt omgezet", legt Tischler uit. "Dit bracht ons op een idee:wat als het enzym ook C-N-bindingen zou kunnen splitsen - traditioneel een moeilijke taak om op te lossen?"
Uit verdere tests bleek dat de biokatalysator hiertoe inderdaad in staat is:hij kan ook formamiden, derivaten van het formiaat met een extra verbinding, als uitgangsmateriaal omzetten in stikstof. Omdat formamiden gebruikelijke en goedkope oplosmiddelen zijn, dienen ze bij deze reactie zowel als oplosmiddel als substraat. In deze opstelling is het ook mogelijk om NADH en NADPH te verstrekken. CO2 wordt ook bij deze reacties als afvalproduct geproduceerd en voorkomt door te ontsnappen dat de reacties achteruit gaan.
"Deze reactie is nog nooit eerder beschreven", zegt Tischler. Zijn team toonde aan dat het gebruik van formamiden als elektronenbron voor de vorming van NADPH gelijkwaardige of zelfs iets betere resultaten kan opleveren vergeleken met het conventionele systeem met formiaat.
"Dit opent compleet nieuwe mogelijkheden, omdat onze stabielere mutanten nog steeds actief zijn in tot wel 40% van het volume aan formamiden", zegt de onderzoeker.
Meer informatie: Artur Maier et al., Ontsluiten van de katalytische diversiteit van een formiaatdehydrogenase:formamide-activiteit voor NADPH-regeneratie en aminetoevoer voor asymmetrische reductieve aminering, ACS-katalyse (2024). DOI:10.1021/acscatal.3c05409
Journaalinformatie: ACS-katalyse
Aangeboden door Ruhr-Universitaet-Bochum
 Een nieuwe klasse vertakte oppervlakteactieve stoffen met enkele keten voor verbeterde oliewinning gerapporteerd
Een nieuwe klasse vertakte oppervlakteactieve stoffen met enkele keten voor verbeterde oliewinning gerapporteerd Een nieuw materiaal dat in staat is tot de adsorptie van organische verontreinigende stoffen in water
Een nieuw materiaal dat in staat is tot de adsorptie van organische verontreinigende stoffen in water Team ontdekt dubbele helixstructuur in synthetisch macromolecuul
Team ontdekt dubbele helixstructuur in synthetisch macromolecuul Hoe een digitale thermometer te veranderen in Fahrenheit lezen
Hoe een digitale thermometer te veranderen in Fahrenheit lezen  Wat is het doel van eenvoudige destillatie?
Wat is het doel van eenvoudige destillatie?
 Hoe windenergie werkt
Hoe windenergie werkt  Een warmer klimaat verhoogde het risico op recordbranden in Australië met 30%
Een warmer klimaat verhoogde het risico op recordbranden in Australië met 30% Kunnen computerspellen boeren helpen zich aan te passen aan klimaatverandering?
Kunnen computerspellen boeren helpen zich aan te passen aan klimaatverandering? nasa, NSF-expeditie om oceaankoolstof te bestuderen, begint in augustus vanuit Seattle
nasa, NSF-expeditie om oceaankoolstof te bestuderen, begint in augustus vanuit Seattle Antarctica:terugkeer van de Weddell-polynya ondersteunt het klimaatmodel van Kiel
Antarctica:terugkeer van de Weddell-polynya ondersteunt het klimaatmodel van Kiel
Hoofdlijnen
- Een 3D-model plantencel maken zonder voedsel
- Het doel van elektroforese
- Hoe chromosomen vals spelen om kans te maken in een ei te komen
- "3-D Printing Goes Cellular
- Hoe een filmmaker, een stapel oude schelpen en een stel amateurs de oesterriffen van Australië terugbrengen
- Foeragerende mieren navigeren efficiënter als ze een energiedrankachtige dosis cafeïne krijgen
- Groenlandse walvissen komen naar Cumberland Sound in Nunavut om te exfoliëren
- Wat is er nodig voor de glycolyse?
- Nieuwe technologie verandert de manier waarop eiwitten in individuele cellen worden bestudeerd
- Zika-viruseiwit in kaart gebracht om het zoeken naar genezing te versnellen
- 'S Werelds oudste insect inspireert een nieuwe generatie aerogels

- Gerecycleerde bureaustoelen omgetoverd tot hard-shell rugzakken en fietstassen

- Nieuwe chemische methode maakt het gemakkelijker om vervuilende pesticiden uit water te halen

- Techniek om transparante polyethyleenfilms zo sterk als aluminium te maken

 Tellurium met weinig lagen als veelbelovende opvolger van zwarte fosfor
Tellurium met weinig lagen als veelbelovende opvolger van zwarte fosfor Kunnen mensen vergiftigd raken door indirecte blootstelling aan polonium-210?
Kunnen mensen vergiftigd raken door indirecte blootstelling aan polonium-210?  China lanceert missie om materiaal van de maan terug te brengen (update)
China lanceert missie om materiaal van de maan terug te brengen (update) Onconventionele technologie verbetert composieten die belangrijk zijn voor de automobiel-, ruimtevaart- en hernieuwbare energie-industrie
Onconventionele technologie verbetert composieten die belangrijk zijn voor de automobiel-, ruimtevaart- en hernieuwbare energie-industrie  NASA vindt intensivering van Tropical Storm Lane
NASA vindt intensivering van Tropical Storm Lane Hoe high-tech stoffen je afkoelen als je opwarmt
Hoe high-tech stoffen je afkoelen als je opwarmt  Onderzoekers stellen nieuwe bovengrens voor neutrinomassa
Onderzoekers stellen nieuwe bovengrens voor neutrinomassa Grafieken van polaire vergelijkingen
Grafieken van polaire vergelijkingen
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

