
Wetenschap
Wetenschappers vinden nieuwe manieren om remmers om te zetten in afbraakproducten, wat de weg vrijmaakt voor toekomstige ontdekkingen van geneesmiddelen
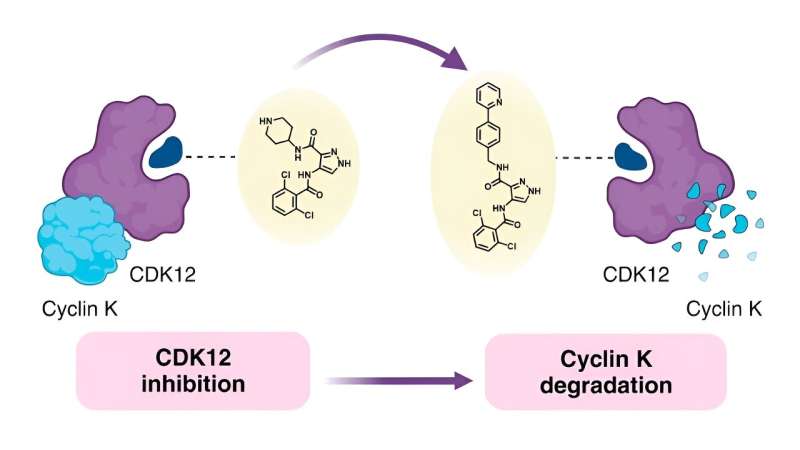
Onderzoekers hebben manieren ontdekt om gerichte kankermedicijnen in de vorm van een remmer om te zetten in kleine moleculen die bekend staan als degraders, die kankerbevorderende eiwitten in cellen helpen vernietigen.
De wetenschappers selecteerden moleculen waarvan bekend is dat ze bepaalde eiwitten remmen (waardoor hun functie stopt) en modificeerden ze op verschillende manieren om ze om te zetten in eiwitafbrekers, die het eiwit afbreken.
Andere wetenschappers kunnen deze nieuwe aanpak nu repliceren om een reeks eiwitafbrekers te ontwikkelen en te optimaliseren. Op de lange termijn kan dit helpen om bestaande kankerbehandelingen effectiever te maken en nieuwe behandelingen te creëren die zich richten op verschillende eiwitten die betrokken zijn bij kanker, waaronder eiwitten die voorheen als 'onmediceerbaar' werden beschouwd.
Het onderzoek, dat werd geleid door onderzoekers van The Institute of Cancer Research, Londen, is gepubliceerd in ACS Chemical Biology .
De noodzaak om gerichte eiwitafbraak te optimaliseren
Wetenschappers over de hele wereld hebben gerichte eiwitafbraak onderzocht als een manier om specifieke eiwitten te elimineren waarvan bekend is dat ze een rol spelen bij de ontwikkeling of progressie van kanker. Cellen breken op natuurlijke wijze beschadigde of onnodige eiwitten af, en het is mogelijk dit proces te kapen door de juiste medicijnmoleculen te introduceren, zodat de cellen kankereiwitten vernietigen.
Het ICR zet zich in voor onderzoek naar gerichte eiwitafbraak als een manier om nieuwe kankerbehandelingen te ontdekken. In 2022 maakte een grote filantropische donatie het mogelijk om een nieuw Centrum voor Eiwitafbraak te openen binnen het Centre for Cancer Drug Discovery van het ICR.
Onderzoekers hebben al enig succes geboekt met behulp van proteolyse-gerichte chimeren (PROTAC's). Deze binden zich aan zowel het eiwit van belang als aan een enzym dat een E3-ubiquitineligase wordt genoemd, om de twee dicht bij elkaar te brengen. Het enzym labelt het eiwit vervolgens met ubiquitine, waardoor het wordt gemarkeerd voor vernietiging door de cel.
Het relatief hoge molecuulgewicht van PROTAC's beperkt echter hun gebruik, omdat ze niet goed in water oplossen en moeite kunnen hebben om in een voldoende hoge concentratie de cellen binnen te dringen om effectief te zijn. Omgekeerd, als de concentratie te hoog wordt, binden de PROTAC's zich allemaal aan slechts één van de twee verbindingen (het enzym of het doeleiwit) in plaats van aan beide, wat betekent dat de eiwitafbraak onvolledig is.
Een recentere ontdekking is het gebruik van monovalente afbraakmiddelen, vaak moleculaire lijmen genoemd. Deze werken op een vergelijkbare manier als PROTAC's, maar ze modificeren het oppervlak van het enzym of het doeleiwit chemisch, zodat de twee direct kunnen binden. Deze verbindingen overwinnen de beperkingen van PROTAC's omdat ze kleiner zijn en nog steeds effectief bij hogere concentraties.
Een moleculair lijmmedicijn, ontdekt na een onderzoeksprogramma bij het ICR, bevindt zich al in een vroeg stadium van klinische proeven.
Remmers omzetten in afbraakproducten
Omdat ze het verband wilden begrijpen tussen de chemische structuur van moleculaire lijmen en hoe ze zich gedragen – bekend als de structuur-activiteitsrelatie (SAR) – besloten de onderzoekers achter de huidige studie een bekende monovalente afbreker genaamd CR8 als uitgangspunt te gebruiken. CR8 remt alle cycline-afhankelijke kinasen (CDK's), die meerdere rollen spelen bij de ontwikkeling van tumoren, maar breekt ook het eiwit cycline K af, dat de signaalroutes van kanker bevordert.
Eerder onderzoek heeft aangetoond dat CR8 bindt aan CDK12 en een E3-ligasecomponent die beschadigd DNA-bindend eiwit 1 (DDB1) wordt genoemd. Hierdoor kan de cel cycline K, gebonden aan CDK12, afbreken.
Gewapend met deze informatie probeerde het team de pyridine in CR8 te vervangen door een breed scala aan vervangers. Ze probeerden eerst eenvoudige groepen te gebruiken, waaronder fluor, methyl en hydroxy, voordat ze overgingen naar complexere formaties om te bepalen hoe deze veranderingen het afbraakvermogen beïnvloedden.
In het tweede deel van het onderzoek pasten de onderzoekers hun toegenomen kennis van de afbrekende SAR toe op andere CDK-remmers om te bepalen of hun bevindingen overdraagbaar waren. Ze ontdekten dat moleculaire componenten die eiwitafbraak induceerden, konden worden gebruikt om meerdere verschillende remmers in afbraakproducten om te zetten. Ze identificeerden ook bepaalde vervangers die tot een betere afbraak leidden.
Eerste auteur Katie Thomas, een Ph.D. student aan de afdeling Cancer Therapeutics aan het ICR, zei:"Het was verrassend om te zien dat zo'n breed scala aan groepen gebruikt kon worden om de afbraak van cycline K te induceren. Dit betekent dat de interactie-interface tussen degrader gebonden CDK12 en DDB1 niet werkt." moeten perfect worden geoptimaliseerd om afbraak te voorkomen. Dit is veelbelovend voor de toekomst van het gebruik van monovalente lijmen als therapeutische modaliteiten; het zal ons helpen moleculen te ontwikkelen van ontdekking tot optimalisatie."
Degraders zijn effectiever dan remmers
Eiwitkinaseremmers worden al meer dan twintig jaar gebruikt bij de behandeling van kanker. Ze werken door de werking van proteïnekinasen te blokkeren, enzymen die de functie van eiwitten controleren en kunnen leiden tot ongereguleerde celgroei als ze muteren.
Hoewel deze behandelingen goed kunnen werken, bestaat het risico dat de kanker er resistent voor wordt. Dit komt omdat remmers kankergerelateerde eiwitten blokkeren in plaats van ze te vernietigen, en de tumorcellen kunnen ze soms reactiveren.
Wanneer sommige proteïnekinasen worden geblokkeerd door remmers, compenseert de cel bovendien door andere kinasen te gebruiken om dezelfde acties uit te voeren.
Door de eiwitten volledig kwijt te raken door eiwitafbraak worden deze risico's weggenomen.
Een basis voor verder werk
Deze studie dient als startpunt voor andere onderzoekers die moleculaire lijmen willen ontwerpen, veelbelovende eiwitdoelen voor afbraak willen identificeren en nieuwe moleculen willen ontwikkelen die kunnen functioneren als afbraaktherapieën.
Thomas zei:"We veronderstellen dat andere remmers van kleine moleculen kunnen worden omgezet in afbrekers door de toevoeging van bepaalde groepen. Ons team onderzoekt momenteel of bepaalde groepen kunnen worden samengevoegd met andere soorten kinaseremmers om ze in monovalente afbrekers te veranderen." wordt momenteel onderzocht of deze verbindingen andere eiwitten kunnen afbreken."
In theorie zal het, zodra onderzoekers een volledig inzicht hebben gekregen in de afbrekende SAR, mogelijk zijn om een reeks kankerbevorderende eiwitten uit verschillende soorten kanker te verwijderen. Deze aanpak zou daarom de deur kunnen openen naar nieuwe effectieve kankerbehandelingen.
Corresponderende auteur Dr. Benjamin Bellenie, Senior Staff Scientist bij de afdeling Cancer Therapeutics bij het ICR, zei:"Deze studie heeft ons begrip rond het ontwerp van monovalente afbraakproducten aanzienlijk verbeterd. We hebben ons specifiek gericht op cycline K-afbraakproducten en moeten dit uitwerken of we deze aanpak kunnen repliceren voor nieuwe doelwitten. Wij geloven echter dat ons onderzoek toekomstige medicijnontdekkingen mogelijk zou kunnen maken."