
Wetenschap
Een tweede kans voor een nieuw antibioticum
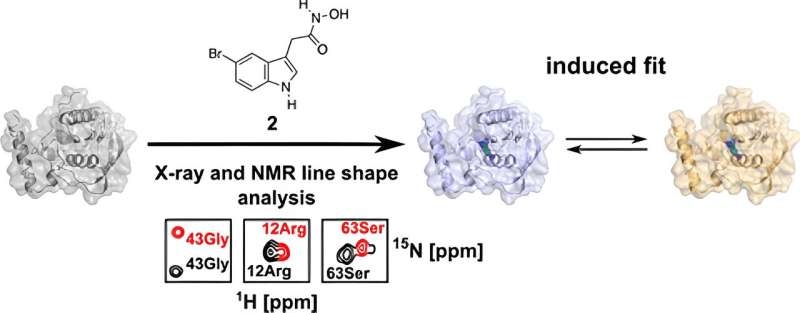
Een toenemend aantal bacteriën is resistent geworden tegen veel gebruikte antibiotica. Onderzoekers uit Bochum hebben een nieuwe kans ontdekt voor een potentieel actief molecuul waarvan de voorganger werd afgewezen. Door de interactie met het bacteriële doeleiwit zeer nauwkeurig in drie dimensies te bestuderen, identificeerden ze een voorheen onopgemerkt aanvalspunt waarop deze verbinding zich zou kunnen richten.
“Aangezien dit aanvalspunt alleen voorkomt in bacteriële eiwitten, zou het medicijn veel selectiever worden en zou de schadelijkheid ervan voor menselijke cellen worden verminderd”, legt professor Raphael Stoll uit, hoofd van de onderzoeksgroep Biomoleculaire NMR Spectroscopie aan de Faculteit Scheikunde en Biochemie. aan de Ruhr Universiteit Bochum, Duitsland.
De onderzoekers publiceerden hun bevindingen op 4 april 2024 in het Journal of Medicinal Chemistry .
Belangrijke pogingen 20 jaar geleden
De studie concentreerde zich op het eiwitpeptide-deformylase (PDF). PDF is betrokken bij eiwitrijpingsprocessen in cellen en is essentieel voor het overleven van bacteriën. Het wordt echter zowel in bacteriën als in menselijke cellen aangetroffen. "Zo'n twintig jaar geleden werden er belangrijke pogingen ondernomen om PDF te bestrijden met antibiotica", benadrukt Stoll.
"Toch moest het oorspronkelijke kandidaat-medicijn, actinonine, om verschillende redenen worden weggegooid. Een van de problemen waarmee we te maken kregen was de nieuw ontdekte menselijke PDF, die mogelijk in verband werd gebracht met bijwerkingen. Toch werd verder onderzoek uitgevoerd om gemodificeerde actieve verbindingen te genereren ”, voegt Hendrik Kirschner toe.
Als onderdeel van zijn proefschrift onderzocht hij PDF in detail in het huidige onderzoek en analyseerde het vanuit het perspectief van de structurele biologie met behulp van biomoleculaire kernmagnetische resonantie (NMR) spectroscopie en röntgenkristallografie. Dankzij deze technieken kon hij een 3D-structuur verkrijgen die tot in het kleinste detail was opgelost.
"Dit is het resultaat van jarenlange samenwerking met onze collega professor Eckhard Hofmann", zegt Stoll.
Het actieve molecuul wordt aangepast en selectiever gemaakt
"We kunnen deze technieken gebruiken om oppervlakken en bindingsplaatsen van biomoleculen te visualiseren en te laten zien dat de binding van het molecuul aan dit eiwit niet statisch is, maar dynamisch", legt Kirschner uit.
De onderzoekers merkten dat er twee verschillende bindingsoriëntaties in het eiwit zijn voor een gemodificeerd medicijnmolecuul:naast de oriëntatie die ook aanwezig is in menselijke PDF, is er nog een andere die in principe uitsluitend zou moeten voorkomen in bacteriële PDF.
"Dit zet ons ertoe aan om het medicijnmolecuul zo aan te passen dat het de voorkeur geeft aan de tweede bindingsoriëntatie", zegt Stoll.
Als gevolg hiervan zou het antibioticummolecuul selectiever kunnen worden gemaakt. "Het zou dit kandidaat-medicijn een tweede kans kunnen geven", besluit Kirschner.