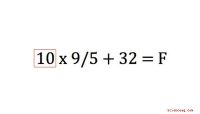Wetenschap
Hoe warmteabsorptie te berekenen
In het dagelijks taalgebruik gebruiken mensen de termen warmte en temperatuur door elkaar. Op het gebied van thermodynamica en fysica in bredere zin hebben de twee termen echter zeer verschillende betekenissen. Als je probeert te berekenen hoeveel warmte door iets wordt geabsorbeerd wanneer je de temperatuur verhoogt, moet je het verschil begrijpen tussen de twee en hoe je de ene van de andere kunt berekenen. Je kunt dit eenvoudig doen: vermenigvuldig gewoon de warmtecapaciteit van de stof die je verwarmt met de massa van de stof en de verandering in temperatuur om de opgenomen warmte te vinden.
TL; DR (Te Lang; Didn ' t Lezen)
Bereken warmteabsorptie met de formule:
Q Q De eerste wet van thermodynamica stelt dat de verandering in interne energie van een stof de som is van de warmte die erop wordt overgedragen en het werk dat erop wordt uitgevoerd (of de warmte die erop wordt overgedragen minus het werk door Warmte is een andere vorm van energieoverdracht, maar het is een die vindt plaats wanneer twee objecten op verschillende temperaturen ten opzichte van elkaar staan. Als je koud water in een pan doet en het fornuis aanzet, verwarmen de vlammen de pan en verwarmt de hete pan het water. Dit verhoogt de temperatuur van het water en geeft het energie. De tweede wet van de thermodynamica dicteert dat warmte alleen stroomt van warmere naar koudere objecten, en niet andersom. De sleutel tot het oplossen van het probleem van het berekenen van warmteabsorptie is het concept van "specific heat capacity.", 1] ,Verschillende stoffen hebben verschillende hoeveelheden energie nodig om erop te worden overgedragen om de temperatuur te verhogen, en de specifieke warmtecapaciteit van de stof vertelt u hoeveel dat is. Dit is een hoeveelheid met het symbool c U kunt de informatie in de laatste twee secties samen met een eenvoudige formule om de warmteabsorptie in een specifieke situatie te berekenen. Het enige dat u moet weten, is de stof die wordt verhit, de verandering in temperatuur en de massa van de stof. De vergelijking is: Q Hier betekent Q Stel u bijvoorbeeld voor dat u de temperatuur van 2 kg water verhoogt van 10 graden C naar 50 graden C. De verandering in temperatuur is ∆ T Q \u003d 334.480 J \u003d 334.5 kJ Dus er is ongeveer 334.5 duizend joules (kJ) warmte nodig om de temperatuur van 2 kg water met 40 graden C te verhogen. Tips over alternatieve eenheden Soms worden specifieke warmtecapaciteiten in verschillende eenheden gegeven . Het kan bijvoorbeeld worden genoteerd in joules /gram graden C, calorieën /gram graden C of joules /mol graden C. Een calorie is een alternatieve energie-eenheid (1 calorie \u003d 4.184 joule), gram is 1/1000 van een kilogram en een mol (afgekort tot mol) is een eenheid die in de chemie wordt gebruikt. Zolang u consistente eenheden gebruikt, blijft de bovenstaande formule behouden. Als de specifieke warmte bijvoorbeeld wordt gegeven in joules /gram graad C, vermeld dan ook de massa van de stof in gram, of converteer de specifieke warmtecapaciteit in kilogram door deze te vermenigvuldigen met 1.000. Als de warmtecapaciteit wordt gegeven in joule /mol graad C, is het ook het gemakkelijkst om de massa van de stof in mol te vermelden. Als de warmtecapaciteit wordt gegeven in calorieën /kg graad C, is je resultaat in calorieën in plaats van joules, die je achteraf kunt converteren als je het antwoord in joules nodig hebt. Als je Kelvin tegenkomt als een eenheid voor temperatuur (symbool K), voor temperatuurveranderingen is dit exact hetzelfde als Celsius, dus u hoeft niets te doen.
\u003d mc
∆ T
betekent de opgenomen warmte, m
is de massa van de stof die warmte absorbeert, c
is de specifieke warmtecapaciteit en ∆ T
is de verandering in temperatuur.
De eerste wet van thermodynamica en warmte
het). "Werk" is slechts een woord dat fysici gebruiken voor fysieke energieoverdracht. Een kopje koffie roeren werkt bijvoorbeeld in de vloeistof erin en je werkt aan een object wanneer je het opraapt of gooit.
Specifieke warmtecapaciteit uitgelegd
en gemeten in joules /kg graden Celsius. Kortom, de warmtecapaciteit vertelt u hoeveel warmte-energie (in joules) nodig is om de temperatuur van 1 kg van een materiaal met 1 graad C te verhogen. De specifieke warmtecapaciteit van water is 4.181 J /kg graad C, en de specifieke de warmtecapaciteit van lood is 128 J /kg graad C. Dit geeft u in één oogopslag aan dat er minder energie nodig is om de temperatuur van lood te verhogen dan water.
Warmteabsorptie berekenen
\u003d mc
∆ T
warmte (wat u wilt weten), m
betekent massa, c
betekent de specifieke warmtecapaciteit en ∆ T
is de verandering in temperatuur. U kunt de temperatuurverandering vinden door de starttemperatuur af te trekken van de eindtemperatuur.
\u003d (50 - 10) graden C \u003d 40 graden C. Uit de laatste sectie is de soortelijke warmtecapaciteit van water 4.181 J /kg graad C, dus de vergelijking geeft :
\u003d 2 kg × 4181 J /kg graden C × 40 graden C
Hoofdlijnen
- De Krebs-cyclus en de Homeostasis
- Wat zijn de effecten van een alkalische pH op de structuur van DNA?
- Neanderthalers hadden grotere hersenen dan moderne mensen - waarom zijn we slimmer?
- Wat is het Forer-effect?
- Phototroph (Prokaryote Metabolism): Wat is het?
- Kan slapen met een hersenschudding je doden?
- Wat is een extra ring van DNA in bacteriën?
- DNA van bevroren dierentuin kan uitsterven van soorten voorkomen
- Wat gebeurt er tijdens de G1-fase?
 Glow Powder maken van huishoudelijke artikelen
Glow Powder maken van huishoudelijke artikelen Lessen geleerd van March Madness 2019
Lessen geleerd van March Madness 2019 Waarom is het oog van een orkaan kalm?
Waarom is het oog van een orkaan kalm?  Zwavelzuur- en chloorbleekreactie
Zwavelzuur- en chloorbleekreactie  Vijf gunstige effecten van micro-organismen
Vijf gunstige effecten van micro-organismen  Effecten van landopruiming
Effecten van landopruiming Wat is een 5P lasstaaf?
Wat is een 5P lasstaaf?  Welke faseveranderingen zijn exotherm & endotherm?
Welke faseveranderingen zijn exotherm & endotherm?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com