
Wetenschap
Een gevierde AI heeft een nieuwe truc geleerd:scheikunde doen
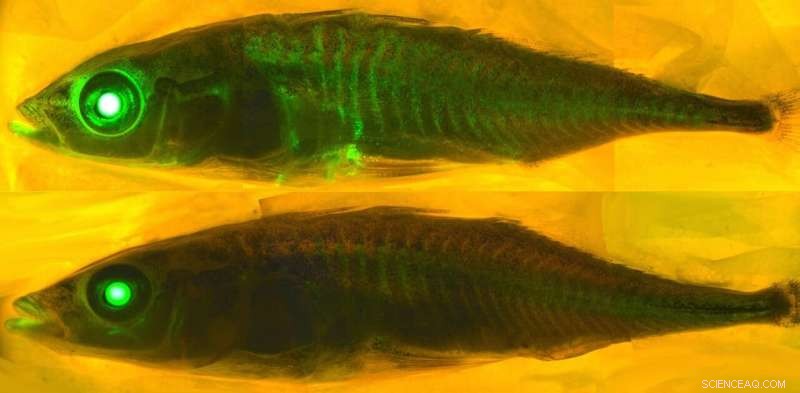
Om erachter te komen wat sommige eiwitten doet gloeien, is een goed begrip van chemie vereist. Krediet:eLife - het tijdschrift, CC BY-SA
Kunstmatige intelligentie heeft de manier waarop wetenschap wordt bedreven veranderd door onderzoekers in staat te stellen de enorme hoeveelheden gegevens te analyseren die moderne wetenschappelijke instrumenten genereren. Het kan een speld vinden in een miljoen hooibergen aan informatie en met behulp van deep learning kan het leren van de gegevens zelf. AI versnelt de vooruitgang op het gebied van genenjacht, medicijnen, medicijnontwerp en de creatie van organische verbindingen.
Deep learning maakt gebruik van algoritmen, vaak neurale netwerken die zijn getraind op grote hoeveelheden data, om informatie uit nieuwe data te halen. Het is heel anders dan traditioneel computergebruik met zijn stapsgewijze instructies. In plaats daarvan leert het van gegevens. Deep learning is veel minder transparant dan traditionele computerprogrammering en laat belangrijke vragen achter:wat heeft het systeem geleerd, wat weet het?
Als hoogleraar scheikunde ontwerp ik graag tests met minstens één moeilijke vraag die de kennis van de studenten verruimt om vast te stellen of ze verschillende ideeën kunnen combineren en nieuwe ideeën en concepten kunnen synthetiseren. We hebben zo'n vraag bedacht voor AlphaFold, het uithangbord van AI-advocaten, die het probleem van het vouwen van eiwitten heeft opgelost.
Eiwit vouwen
Eiwitten zijn aanwezig in alle levende organismen. Ze geven de cellen structuur, katalyseren reacties, transporteren kleine moleculen, verteren voedsel en doen nog veel meer. Ze zijn opgebouwd uit lange ketens van aminozuren, zoals kralen aan een touwtje. Maar om een eiwit zijn werk in de cel te laten doen, moet het draaien en buigen in een complexe driedimensionale structuur, een proces dat eiwitvouwing wordt genoemd. Verkeerd gevouwen eiwitten kunnen tot ziekte leiden.
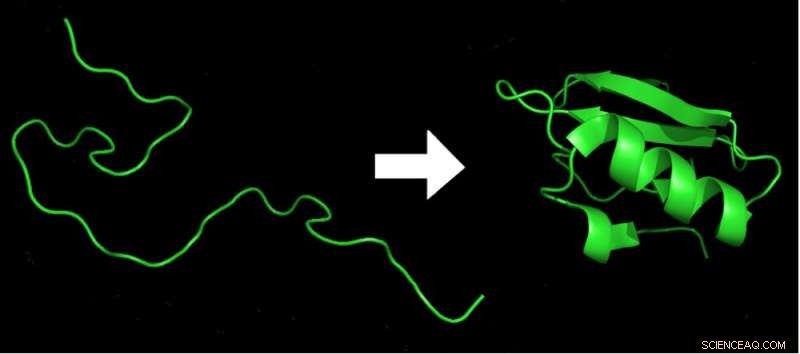
Binnen milliseconden na het verlaten van een aminozuurketen (links) uit het ribosoom, wordt het gevouwen in de 3D-vorm met de laagste energie (rechts), die nodig is voor de functie van het eiwit. Krediet:Marc Zimmer, CC BY-ND
Christiaan Anfinsen stelde in zijn Nobelprijsuitreiking voor scheikunde in 1972 dat het mogelijk moet zijn om de driedimensionale structuur van een eiwit te berekenen uit de volgorde van zijn bouwstenen, de aminozuren.
Net zoals de volgorde en de spatiëring van de letters in dit artikel het betekenis en boodschap geven, zo bepaalt de volgorde van de aminozuren de identiteit en vorm van het eiwit, wat resulteert in zijn functie.
Vanwege de inherente flexibiliteit van de aminozuurbouwstenen, kan een typisch eiwit naar schatting 10 tot 300 verschillende vormen aannemen. Dit is een enorm aantal, meer dan het aantal atomen in het universum. Maar binnen een milliseconde zal elk eiwit in een organisme vouwen in zijn eigen specifieke vorm - de laagste energierangschikking van alle chemische bindingen waaruit het eiwit bestaat. Verander slechts één aminozuur in de honderden aminozuren die typisch in een eiwit worden gevonden en het kan misvouwen en niet langer werken.
AlphaFold
Al 50 jaar proberen computerwetenschappers het probleem van het vouwen van eiwitten op te lossen - met weinig succes. In 2016 startte DeepMind, een AI-dochteronderneming van het moederbedrijf van Google, Alphabet, zijn AlphaFold-programma. Het gebruikte de eiwitdatabank als trainingsset, die de experimenteel bepaalde structuren van meer dan 150.000 eiwitten bevat.
Neuronen die fluorescerende eiwitten tot expressie brengen, onthullen de hersenstructuren van twee fruitvlieglarven. Credit:Wen Lu en Vladimir I. Gelfand, Feinberg School of Medicine, Northwestern University
In minder dan vijf jaar had AlphaFold het probleem van het vouwen van eiwitten overwonnen - althans het meest bruikbare deel ervan, namelijk het bepalen van de eiwitstructuur op basis van de aminozuursequentie. AlphaFold legt niet uit hoe de eiwitten zo snel en nauwkeurig vouwen. Het was een grote overwinning voor AI, want het verwierf niet alleen een enorm wetenschappelijk prestige, het was ook een grote wetenschappelijke vooruitgang die van invloed zou kunnen zijn op ieders leven.
Tegenwoordig kunnen onderzoekers zoals ik, dankzij programma's als AlphaFold2 en RoseTTAFold, de driedimensionale structuur van eiwitten bepalen uit de sequentie van aminozuren waaruit het eiwit bestaat - zonder kosten - in een uur of twee. Vóór AlphaFold2 moesten we de eiwitten kristalliseren en de structuren oplossen met behulp van röntgenkristallografie, een proces dat maanden in beslag nam en tienduizenden dollars per structuur kostte.
We hebben nu ook toegang tot de AlphaFold Protein Structure Database, waar Deepmind de 3D-structuren heeft gedeponeerd van bijna alle eiwitten die voorkomen bij mensen, muizen en meer dan 20 andere soorten. Tot op heden hebben ze meer dan een miljoen constructies opgelost en zijn van plan om dit jaar alleen al 100 miljoen constructies toe te voegen. De kennis van eiwitten is omhooggeschoten. De structuur van de helft van alle bekende eiwitten zal waarschijnlijk tegen het einde van 2022 worden gedocumenteerd, waaronder veel nieuwe unieke structuren die verband houden met nieuwe nuttige functies.
Denken als een chemicus
AlphaFold2 is niet ontworpen om te voorspellen hoe eiwitten met elkaar zouden interageren, maar het is wel in staat geweest om te modelleren hoe individuele eiwitten combineren om grote complexe eenheden te vormen die uit meerdere eiwitten zijn samengesteld. We hadden een uitdagende vraag voor AlphaFold:had de structurele trainingsset het wat chemie geleerd? Zou het kunnen vertellen of aminozuren met elkaar zouden reageren - een zeldzame maar belangrijke gebeurtenis?
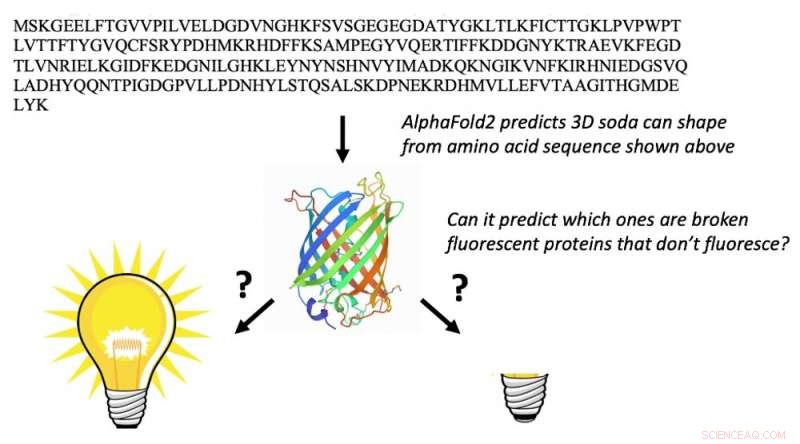
AlphaFold2 kan de aminozuursequentie van fluorescerende eiwitten (letters bovenaan) nemen en hun 3D-vatvormen voorspellen (midden). Dit is niet verrassend. Wat totaal onverwacht is, is dat het ook kan voorspellen welke fluorescerende eiwitten ‘gebroken’ zijn en niet kunnen fluoresceren. Krediet:Marc Zimmer, CC BY-ND
Ik ben een computerchemicus die geïnteresseerd is in fluorescerende eiwitten. Dit zijn eiwitten die voorkomen in honderden mariene organismen zoals kwallen en koraal. Hun gloed kan worden gebruikt om ziekten te verlichten en te bestuderen.
Er zijn 578 fluorescerende eiwitten in de eiwitdatabank, waarvan er 10 "gebroken" zijn en niet fluoresceren. Eiwitten vallen zichzelf zelden aan, een proces dat autokatalytische posttranslationele modificatie wordt genoemd, en het is erg moeilijk te voorspellen welke eiwitten met zichzelf zullen reageren en welke niet.
Alleen een chemicus met een aanzienlijke hoeveelheid kennis van fluorescerende eiwitten zou in staat zijn om de aminozuursequentie te gebruiken om de fluorescerende eiwitten te vinden die de juiste aminozuursequentie hebben om de chemische transformaties te ondergaan die nodig zijn om ze fluorescerend te maken. Toen we AlphaFold2 presenteerden met de sequenties van 44 fluorescerende eiwitten die niet in de eiwitdatabank staan, vouwde het de gefixeerde fluorescerende eiwitten anders dan de kapotte.
Het resultaat verbaasde ons:AlphaFold2 had wat scheikunde geleerd. Het had ontdekt welke aminozuren in fluorescerende eiwitten de chemie doen waardoor ze gloeien. We vermoeden dat de trainingsset van de eiwitdatabank en de uitlijning van meerdere sequenties AlphaFold2 in staat stellen te "denken" als scheikundigen en te zoeken naar de aminozuren die nodig zijn om met elkaar te reageren om het eiwit fluorescerend te maken.
Een vouwprogramma dat wat scheikunde leert van zijn trainingsset, heeft ook bredere implicaties. Wat valt er nog meer te winnen bij andere deep learning-algoritmen door de juiste vragen te stellen? Kunnen gezichtsherkenningsalgoritmen verborgen markers voor ziekten vinden? Zouden algoritmen die zijn ontworpen om bestedingspatronen van consumenten te voorspellen, ook een neiging kunnen vinden tot kleine diefstal of bedrog? En het belangrijkste:is deze mogelijkheid - en vergelijkbare sprongen in vaardigheden in andere AI-systemen - wenselijk? + Verder verkennen
Onthouden eiwitten zich?
Dit artikel is opnieuw gepubliceerd vanuit The Conversation onder een Creative Commons-licentie. Lees het originele artikel. 
 Nieuw scheidingsproces voor belangrijk radiodiagnostisch middel vermindert radioactief afval
Nieuw scheidingsproces voor belangrijk radiodiagnostisch middel vermindert radioactief afval Nieuwe spin-overgang metaal-organische raamwerken gebruiken veel minder energie om vast te leggen, hergebruik koolmonoxide
Nieuwe spin-overgang metaal-organische raamwerken gebruiken veel minder energie om vast te leggen, hergebruik koolmonoxide Nieuwe wetenschap achter biologisch afbreekbare teenslippers op basis van algen
Nieuwe wetenschap achter biologisch afbreekbare teenslippers op basis van algen Moleculaire simulaties gebruiken om zelf-assemblerende, associërende polymeren te bestuderen
Moleculaire simulaties gebruiken om zelf-assemblerende, associërende polymeren te bestuderen UCI-wetenschappers zijn de eersten om te observeren, afbeelding allerbelangrijkste moleculaire trillingen
UCI-wetenschappers zijn de eersten om te observeren, afbeelding allerbelangrijkste moleculaire trillingen
 NASA's GPM onderzoekt zwakkere tropische storm Yutus-regenval
NASA's GPM onderzoekt zwakkere tropische storm Yutus-regenval Wat veroorzaakt verschillen in waterkwaliteit tijdens verschillende hydrologische perioden in Dongting Lake, China?
Wat veroorzaakt verschillen in waterkwaliteit tijdens verschillende hydrologische perioden in Dongting Lake, China? Biotische factoren voor een jachtluipaard
Biotische factoren voor een jachtluipaard  Scrub Oak Informatie
Scrub Oak Informatie  Nieuwe kaarten ter ondersteuning van besluitvorming na een aardbeving
Nieuwe kaarten ter ondersteuning van besluitvorming na een aardbeving
Hoofdlijnen
- IJsbeerblogs onthullen gevaarlijke kloof tussen feiten en meningen over klimaatverandering
- Skelet van enorme dinosaurus opgegraven in Portugal
- Huilende olifanten en giechelende ratten - dieren hebben gevoelens, te
- Hoe een onbekende bacterie te identificeren in de microbiologie
- Geavanceerde beeldvorming werpt licht op immuunontsnapping van vormveranderende schimmel
- Verschil tussen differentiatie en morfogenese
- Kwam Eiwit, DNA of RNA als eerste?
- Tasmaanse tijger gedoemd lang voordat er mensen kwamen
- Designergist verbruikt plantaardig materiaal en spuugt vetalcoholen uit voor wasmiddelen en biobrandstoffen
- Chemici nemen de plek waar water en lucht samenkomen onder de loep
- Flubber maken zonder Borox of Liquid Starch

- 3D-geprinte polymeerstents groeien mee met pediatrische patiënten en worden na verloop van tijd biologisch afgebroken

- AI versterkt vegetarische hamburgers terwijl de markt groeit

- Koperion ontsluit magnesiumpotentieel in batterijen van de volgende generatie
 Video:Huygens afdaling naar Titan
Video:Huygens afdaling naar Titan Hoe bereken je een rond gebied tot een vierkant Feet
Hoe bereken je een rond gebied tot een vierkant Feet Voormalige EPA-adviseurs zeggen dat het kwikvoorstel van bureaus gebrekkig is
Voormalige EPA-adviseurs zeggen dat het kwikvoorstel van bureaus gebrekkig is Apples rivalen in streaming video
Apples rivalen in streaming video Potentieel grote economische gevolgen van klimaatverandering kunnen worden vermeden door menselijk handelen
Potentieel grote economische gevolgen van klimaatverandering kunnen worden vermeden door menselijk handelen Colombia verbiedt sportjacht
Colombia verbiedt sportjacht Overwatch League-commissaris vertrekt om aan Fortnite te werken
Overwatch League-commissaris vertrekt om aan Fortnite te werken Land kan ongeveer een kwart van de maandelijkse neerslag vasthouden
Land kan ongeveer een kwart van de maandelijkse neerslag vasthouden
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

