Wetenschap
Snellere ontdekking van medicijnen om onbetrouwbare doelen te bereiken
Krediet:CC0 Publiek Domein
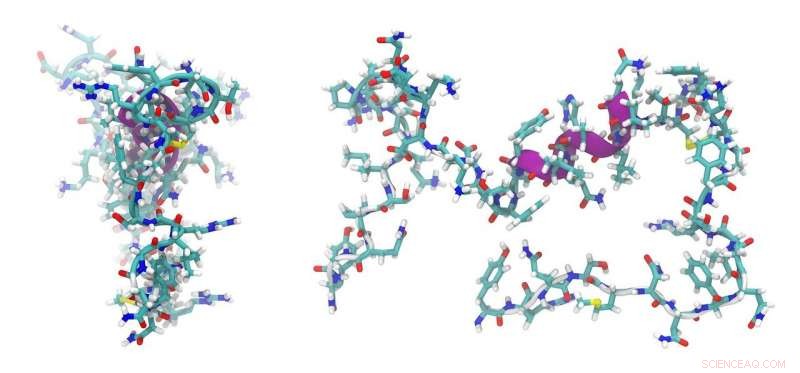
Geneesmiddelen gemaakt van opgerolde eiwitfragmenten kunnen een nieuw handvat bieden voor moeilijk te behandelen ziekten zoals kanker, maar ze zijn moeilijk te ontwerpen. Maar een nieuwe techniek ontwikkeld aan de Universiteit van Michigan, zou dat kunnen veranderen.
Het kan bacteriën gebruiken om miljarden verschillende kandidaat-geneesmiddelen te produceren die niet snel uiteenvallen in het lichaam.
Sommige geavanceerde kankermedicijnen richten zich op kankercellen met immuunmarkers die zich aan de buitenkant van de kankercellen hechten, bijvoorbeeld. Maar deze immuunmarkers zijn groot, werken tussen cellen in plaats van erin. Om kankercellen van binnenuit te verstoren, het geneesmiddel moet klein genoeg zijn om in de cel te komen.
Echter, gewone medicijnen met kleine moleculen kunnen messenger-eiwitten met gladde oppervlakken niet raken. Er is een nieuw type medicatie nodig.
"Het is een Goudlokje-principe, " zei Greg Thurber, U-M universitair hoofddocent chemische technologie, die het werk leidde. "Het medicijn moet klein genoeg zijn om in cellen te komen, maar groot genoeg om eiwitten in cellen te grijpen die geen interactie hebben met gewone medicijnen met kleine moleculen."
eiwit fragmenten, bekend als peptiden, zou deze leemte kunnen opvullen. Ze zijn klein genoeg om in cellen te glippen, maar complex genoeg om te binden met gladde eiwitten.
Een voorbeeld van een "niet-overdraagbaar" doelwit is MDM2, een eiwit dat een ander eiwit buitenspel zet dat bekend staat als de 'bewaker van het genoom'. Deze voogd, bekend als p53, stopt de celdeling wanneer genetische mutaties optreden, tijd kopen voor DNA-reparatie. Het kan ook zelfvernietiging initiëren als het genoom in slechte staat is. Het is onze eerstelijns verdediging tegen kanker.
Echter, kankercellen vechten terug door overproductie van de remmer van p53, MDM2, die zich bindt aan p53 en verhindert dat het zijn werk doet. Maar als iets de MDM2 onderschept voordat het de p53 verbindt, de kankercellen kunnen iedereen een plezier doen en zichzelf vernietigen.
Dit is slechts een van de therapieën die mogelijk zijn met peptiden. En het U-M-team heeft een manier ontwikkeld om ze te ontwerpen. De belangrijkste innovatie is hoe het team van Thurber de peptiden stabiliseerde, die vatbaar zijn voor uiteenvallen in complexe omgevingen zoals het menselijk lichaam.
"Het peptide is als een Slinky, maar je knoopt schakels aan elkaar zodat het niet uitrekt. Dat is wat we chemisch doen, ' zei Thurber.
Dankzij de stropdas kunnen verschillende kandidaat-geneesmiddelen worden gebouwd met bacteriën in plaats van met eenvoudigere organismen. zoals fagen, die in wezen virussen zijn voor bacteriën. Fagen maken slechts vijf peptiden tegelijk, in plaats van de 10, 000 of zo die bacteriën kunnen maken.
De peptiden op bacteriën zijn zo overvloedig dat onderzoekers kunnen zien hoe goed ze direct op de bacterie werken. In tegenstelling tot, de faagmethode vereist extra arbeidsintensieve stappen om erachter te komen hoe goed peptiden binden en of ze gemakkelijk uit elkaar vallen.
Het team van Thurber gebruikte E. coli-bacteriën om honderden miljoenen peptiden te bouwen met willekeurige variaties, op zoek naar degene die het beste was in het binden van MDM2. De instructies voor de peptiden werden geschreven in ringen van genetische code die de onderzoekers in de bacteriën glipten, waardoor de bacteriën de peptiden op hun celmembranen produceren.
De stropdassen waren gemaakt van synthetische moleculen die de bacteriën verwisselden voor een peptidebouwsteen die ze niet konden produceren. In tegenstelling tot eerdere bindingen die zijn opgenomen in door fagen opgebouwde peptiden, de synthetische moleculen binden zich niet aan andere moleculen in en rond de bacteriën. Het is een voorbeeld van "klikchemie, " nette enclaves in de rommelige wereld van de organische chemie waarin moleculen betrouwbaar met elkaar reageren, maar verder inert zijn.
"Het probleem was dat de reactie om de spoelen aan elkaar te binden de bacteriën doodde, " zei Tejas Navaratna, een doctoraat student chemische technologie aan de U-M en eerste auteur van de studie in de Tijdschrift van de American Chemical Society . "We hebben maandenlang geprobeerd om de reactie te optimaliseren, zodat de bacteriën het overleefden, maar uiteindelijk realiseerden we ons dat we het DNA moesten extraheren dat onze beste peptiden codeerde en het toevoegen aan verse, levende bacteriën."
Elke bacterie produceerde een ander peptide, waardoor het team honderden miljoenen verschillende ontwerpen kon testen. Om erachter te komen of de peptiden werkten, de onderzoekers vermengden MDM2 - gehecht aan fluorescerende moleculen - met de bacteriën. De cellen die oplichtten, produceerden een potentieel nuttig medicijn.
Hoewel deze techniek vooral aantrekkelijk is voor het vinden van nieuwe kankermedicijnen, opgerolde peptiden worden onderzocht voor het beheersen van diabetes en HIV. De grootste uitdaging is om de peptiden in cellen te krijgen, dat is een probleem dat het team van Thurber momenteel nastreeft.
 Wat zijn de functies van co-enzymen?
Wat zijn de functies van co-enzymen?  Wetenschappers berekenen kristalstructuur van superharde molybdeenboriden
Wetenschappers berekenen kristalstructuur van superharde molybdeenboriden Onder druk:eiwit-nabootsende moleculen manipuleren met hydrostatische druk
Onder druk:eiwit-nabootsende moleculen manipuleren met hydrostatische druk De groeiende mogelijkheden van biobased polymeren
De groeiende mogelijkheden van biobased polymeren Biochemici koppelen synthetische verbinding aan de productie van hongerhormonen
Biochemici koppelen synthetische verbinding aan de productie van hongerhormonen
 Vulkaanuitbarstingen hadden het afgelopen millennium grote en aanhoudende gevolgen voor het wereldwijde hydroklimaat
Vulkaanuitbarstingen hadden het afgelopen millennium grote en aanhoudende gevolgen voor het wereldwijde hydroklimaat Overstromingen dwingen duizenden huizen in Myanmar te verlaten
Overstromingen dwingen duizenden huizen in Myanmar te verlaten Canadese regering stapt in om controversiële pijpleiding te kopen
Canadese regering stapt in om controversiële pijpleiding te kopen Studie meet toename luchtvervuiling toe te schrijven aan airconditioning
Studie meet toename luchtvervuiling toe te schrijven aan airconditioning Grotgeheimen ontgrendeld om patronen van droogte en regen uit het verleden te tonen
Grotgeheimen ontgrendeld om patronen van droogte en regen uit het verleden te tonen
Hoofdlijnen
- The Anatomy of the Hydra
- Vrouwelijke mangoesten helpen hun pups door rivalen te verdrijven
- Kun je je familie aanzien voor bedriegers?
- Een driedimensionaal tandmodel maken voor een schoolproject
- "What Does Heterozygous Mean?
- Studie vindt dat black box-methoden die door biologen worden gebruikt, waarschijnlijk het aantal nieuwe soorten overschatten
- Jacht op herten beperkt in westelijke Amerikaanse staten na strenge winter
- Kill-schakelaars voor gemanipuleerde microben die schurkenstaten zijn geworden
- Basisvereisten voor groei in prokaryoten en eukaryoten
 Cumulatieve relatieve frequentie berekenen
Cumulatieve relatieve frequentie berekenen  Wat gebeurt er als een land verdrinkt?
Wat gebeurt er als een land verdrinkt? De Super-Kamiokande-detector wacht op neutrino's van een supernova
De Super-Kamiokande-detector wacht op neutrino's van een supernova Een tegengif voor zenuwgas dat vóór een aanval kan worden ingenomen
Een tegengif voor zenuwgas dat vóór een aanval kan worden ingenomen Stikstofdioxide detecteren:revolutionair nieuw wapen in de strijd tegen luchtvervuiling
Stikstofdioxide detecteren:revolutionair nieuw wapen in de strijd tegen luchtvervuiling Door droogte getroffen tondeldoos Californië zet zich schrap voor branden in de komende maanden
Door droogte getroffen tondeldoos Californië zet zich schrap voor branden in de komende maanden Is uw supercomputer stumped? Er is misschien een kwantumoplossing
Is uw supercomputer stumped? Er is misschien een kwantumoplossing In legeringen met vormgeheugen, de juiste combinatie van kristalkorrels kan een hoge sterkte bereiken en toch geheugen behouden
In legeringen met vormgeheugen, de juiste combinatie van kristalkorrels kan een hoge sterkte bereiken en toch geheugen behouden
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com